
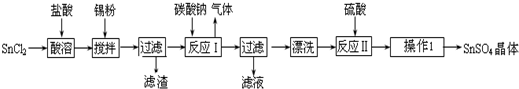
分析 (1)錫原子的核電荷數為50,與碳元素屬于同一主族,處于ⅣA族,根據原子序數減各周期容納元素種數確定所在的周期;
(2)由流程圖可知,操作Ⅰ是從溶液中得到含結晶水的晶體,只能采取蒸發、濃縮、冷卻結晶、過濾、洗滌得到;
(3)由信息可知,SnCl2易水解生成堿式氯化亞錫,加入鹽酸,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除調節溶液pH外,還防止Sn2+被氧化;
(5)反應Ⅰ得到沉淀是SnO,Sn元素化合價為變化,屬于非氧化還原反應,同時生成氣體,該氣體為二氧化碳;
(6)酸性條件下,SnSO4還可以用作雙氧水去除劑,雙氧水有強氧化性,將Sn2+易被氧化為Sn4+,自身被還原為水;
(7)根據電子轉移守恒與方程式可得關系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,據此計算.
解答 解:(1)錫元素與碳元素屬于同一主族,處于ⅣA族,原子核電荷數為50,則:50-2-8-8-18=14,故Sn處于第五周期,則在周期表中的位置為:第五周期第ⅣA族,
故答案為:第五周期第ⅣA族;
(2)由流程圖可知,操作Ⅰ是從溶液中得到含結晶水的晶體,只能采取蒸發濃縮、冷卻結晶、過濾、洗滌得到,
故答案為:蒸發濃縮、冷卻結晶;
(3)由信息可知,SnCl2易水解生成堿式氯化亞錫,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解,
故答案為:SnCl2水解反應為SnCl2+H2O?Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除調節溶液pH外,還防止Sn2+被氧化;
故答案為:防止Sn2+被氧化;
(5)反應Ⅰ得到沉淀是SnO,Sn元素化合價為變化,屬于非氧化還原反應,同時生成氣體,該氣體為二氧化碳,離子方程式為:Sn2++CO32-═SnO↓+CO2↑,
故答案為:Sn2++CO32-═SnO↓+CO2↑;
(6)酸性條件下,SnSO4還可以用作雙氧水去除劑,雙氧水有強氧化性,將Sn2+易被氧化為Sn4+,自身被還原為水,離子方程式為:Sn2++H2O2+2H+═Sn4++2H2O,
故答案為:Sn2++H2O2+2H+═Sn4++2H2O;
(7)令錫粉中錫的質量分數為x,則:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7計算.
119g $\frac{1}{3}$mol
1.226g×x 0.100mol/L×0.032L
故:$\frac{19g}{1.226xg}$=$\frac{\frac{1}{3}mol}{0.100mol/L×0.032L}$,
解得:x=93.2%,
故答案為:93.2%.
點評 本題SnSO4制備的之比為載體,考查學生對工藝流程的理解、物質的分離提純、閱讀題目獲取信息的能力、常用化學用語書寫、滴定應用及利用關系式進行的計算等,難度中等,對學生的基礎知識及邏輯推理有較高的要求.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素的單質氧化性:Z>Y>X | B. | 最高正化合價:Z>Y | ||
| C. | 原子半徑:Z<Y<X | D. | 氣態氫化物的穩定性:Z<Y<X |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
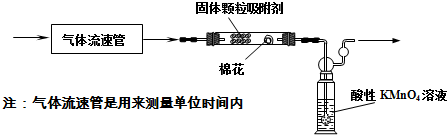
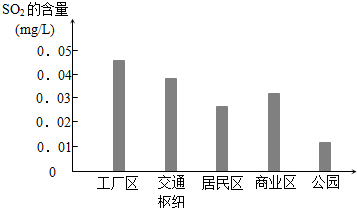
 某研究性學習小組在研究二氧化硫漂白作用時,從“氯氣的漂白作用實際上是氯氣與水反應生成的次氯酸的漂白作用”得到啟發.為了探究二氧化硫作用得到底是二氧化硫本身還是二氧化硫與水作用的產物,該小組設計了如下實驗.請回答相關問題.
某研究性學習小組在研究二氧化硫漂白作用時,從“氯氣的漂白作用實際上是氯氣與水反應生成的次氯酸的漂白作用”得到啟發.為了探究二氧化硫作用得到底是二氧化硫本身還是二氧化硫與水作用的產物,該小組設計了如下實驗.請回答相關問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙中C的轉化率為20% | |
| B. | Q1+Q2=Q | |
| C. | 達到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反應方向移動 | |
| D. | 乙中的熱化學反應方程式為2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 取樣,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取樣,先加鹽酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取樣,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取樣,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
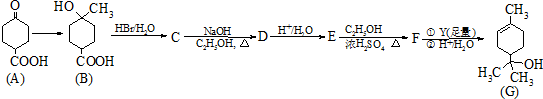
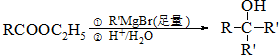
 .
.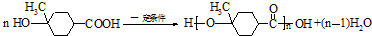 .
. .
.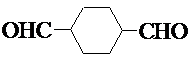 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
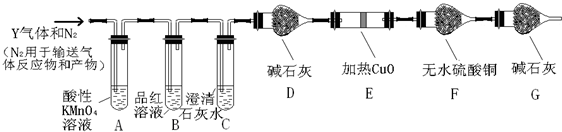
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在化工生產中應遵循“綠色化學”的思想 | |
| B. | 在元素周期表的過渡元素中尋找優良的催化劑 | |
| C. | 汽車尾氣中產生NO的原因是空氣中的N2與O2在汽車汽缸內的高溫環境下發生反應的產物 | |
| D. | 根據元素周期律,由HClO4可以類推出氟元素也存在最高價氧化物的水化物HFO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com