
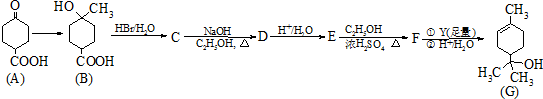
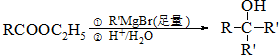
 .
.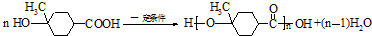 .
. .
. .
.分析 由A、B的結構可知,A與甲烷發生加成反應生成B,B與HBr發生取代反應生成C為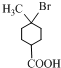 ,C發生消去反應生成D為
,C發生消去反應生成D為 ,D酸化得到E為
,D酸化得到E為 ,E與乙醇發生酯化反應生成F為
,E與乙醇發生酯化反應生成F為 ,F發生信息反應生成G,結合F與G的結合可知Y為CH3MgBr,據此解答.
,F發生信息反應生成G,結合F與G的結合可知Y為CH3MgBr,據此解答.
解答 解:由A、B的結構可知,A與甲烷發生加成反應生成B,B與HBr發生取代反應生成C為 ,C發生消去反應生成D為
,C發生消去反應生成D為 ,D酸化得到E為
,D酸化得到E為 ,E與乙醇發生酯化反應生成F為
,E與乙醇發生酯化反應生成F為 ,F發生信息反應生成G,結合F與G的結合可知Y為CH3MgBr,
,F發生信息反應生成G,結合F與G的結合可知Y為CH3MgBr,
(1)F為 ,F中所含官能團的名稱是酯基,B→C的反應類型為 取代反應,
,F中所含官能團的名稱是酯基,B→C的反應類型為 取代反應,
故答案為:酯基; 取代反應;
(2)根據A的結構簡式可知,A的核磁共振氫譜有4個吸收峰,面積比為 1:1:4:4,
故答案為:4;1:1:4:4;
(3)C→D的化學方程式為  ,
,
故答案為: ;
;
(4)B中含有羥基和羧基,則B在一定條件下聚合成高分子化合物的化學方程式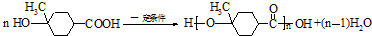 ,
,
故答案為: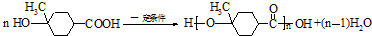 ;
;
(5)根據G的結構簡式可知,G中有碳碳雙鍵,G可以與H2O催化加成得到化合物H為  ,
,
故答案為: ;
;
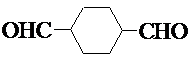
(6)E為 ,根據條件①只有3種環境的氫原子,說明分子結構較為對稱,②能發生銀鏡反應,能發生銀鏡反應,說明有醛基,③分子中含六元環,則符合條件的E的同分異構體的結構簡式為
,根據條件①只有3種環境的氫原子,說明分子結構較為對稱,②能發生銀鏡反應,能發生銀鏡反應,說明有醛基,③分子中含六元環,則符合條件的E的同分異構體的結構簡式為
故答案為:
點評 本題考查有機物的推斷與合成,難度中等,充分利用有機物的結構、反應條件及反應信息進行判斷,掌握官能團的性質與理解反應信息是關鍵,能較好的考查考生的閱讀、自學能力和思維能力,是熱點題型.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
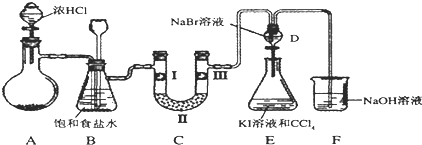
| a | b | c | d | |
| I | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| II | 堿石灰 | 無水氯化鈣 | 堿石灰 | 無水氯化鈣 |
| III | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
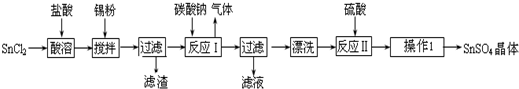
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④ | B. | ①②⑤⑧ | C. | ①②③④⑦ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.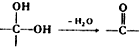
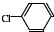 中氯原子較難水解物質A(
中氯原子較難水解物質A( 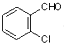 )可由2-氯甲苯為原料制得,寫出以兩步制備A的化學方程式
)可由2-氯甲苯為原料制得,寫出以兩步制備A的化學方程式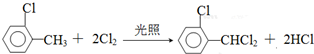 、
、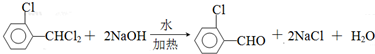 .該合成的第一步主要存在產率低的問題,請寫出該步可能存在的有機物雜質的結構簡式
.該合成的第一步主要存在產率低的問題,請寫出該步可能存在的有機物雜質的結構簡式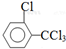 、
、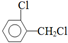 .
.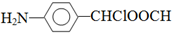 .
.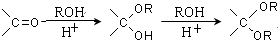
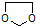 的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下: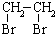
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
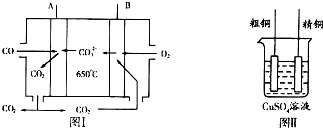
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
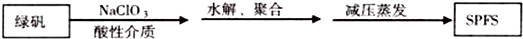
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com