
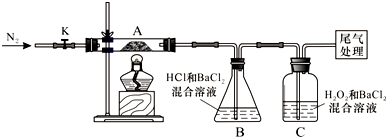
分析 I.摩爾鹽中N為-3價,Fe為+2價,S為+6價,根據產物中化合價分析,a 中生成Fe2O3,只有鐵元素的化合價升高,沒有元素化合價降低,c中生成FeO、SO2,其中鐵元素和硫元素的化合價均降低,但是沒有元素化合價升高,不符合電荷守恒;
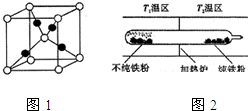
II.取一定量“摩爾鹽”置于加熱管A中,加熱至分解完后打開K,再通入N2,使分解產生的氣體在B、C中被吸收充分,分解得到氣體通過甲同學設計了的實驗裝置,觀察到A中固體逐漸變為紅棕色,說明生成物中含氧化鐵,B、C中均產生白色沉淀,證明生成氣體中一定含二氧化硫和三氧化硫,
(1)根據裝置圖分析;
(2)A中固體充分加熱較長時間后,通入氮氣目的是使分解生成的氣體在BC裝置中完全吸收;
(3)C中有白色沉淀生成,是因為SO2被雙氧水氧化成SO42-,SO42-再與Ba2+結合成沉淀BaSO4;
(4)A中固體逐漸變為紅棕色說明有氧化鐵生成,用硫酸溶解,溶液中有Fe3+;
(5)把固體用非氧化性酸溶解,再用K3[Fe(CN)6]溶液檢驗,乙同學設計實驗驗證A中殘留物不含FeO,考慮是檢驗二價亞鐵離子,操作方法及實驗現象是:取少量A中殘留物放入試管中,加入稀硫酸(鹽酸)溶解,再滴加K3[Fe(CN)6]溶液,不產生藍色沉淀;
III.氨氣過量時,二氧化硫與氨氣生成亞硫酸銨,再與BaCl2溶液反應生成白色沉淀.
解答 解:I.摩爾鹽中N為-3價,Fe為+2價,S為+6價,
a.Fe2O3、SO3、NH3、H2O 反應時只有Fe元素的化合價升高,不符合氧化還原反應規律,故a錯誤;
b.FeO、NH3、SO3、H2O,反應時沒有元素化合價的變化,只是發生分解反應,故b正確;
c.FeO、SO2、NH3、H2O反應時只有S元素的化合價降低,不符合氧化還原反應規律,故c錯誤;
d.Fe2O3、NH3、SO2、SO3、H2O反應時,Fe的化合價升高,S的化合價降低,符合氧化還原反應規律,故d正確.
故答案為:ac;
II.(1)由裝置圖可知,B裝置是錐形瓶;故答案為:錐形瓶;
(2)A中固體充分加熱較長時間后,產生氣體有一部分殘留在裝置中,通入氮氣可以使分解生成的氣體在B、C裝置中完全吸收;
故答案為:使分解產生的氣體在B、C中被吸收充分;
(3)C中有白色沉淀生成,是因為SO2被雙氧水氧化成SO42-,SO42-再與Ba2+結合成沉淀BaSO4則C中發生的反應為SO2+H2O2+Ba2+=BaSO4↓+2H+;
故答案為:SO2+H2O2+Ba2+=BaSO4↓+2H+;
(4)A中固體逐漸變為紅棕色說明有氧化鐵生成,用硫酸溶解,溶液中有Fe3+,在溶液中滴幾滴KSCN溶液,則溶液會變紅色;
故答案為:溶液變紅色;
(5)要驗證A中殘留物不含FeO,先取少量A中殘留物放入試管中,再加入稀硫酸或鹽酸溶解,然后滴加K3[Fe(CN)6]溶液檢驗,若不產生藍色沉淀,說明沒有Fe2+;
故答案為:加稀硫酸溶解,再滴加K3[Fe(CN)6]溶液,不產生藍色沉淀,說明沒有Fe2+;
III.氨氣過量時,產生的氨氣消耗完B裝置中的HCl后二氧化硫與氨氣生成亞硫酸銨,亞硫酸銨與BaCl2溶液反應生成BaSO3沉淀,所以不能說明分解產物中一定含SO3,故答案為:分解產生的氨氣消耗完B裝置中的HCl后,過量的氨氣存在時二氧化硫與BaCl2溶液反應生成白色沉淀.
點評 本題考查了物質性質的實驗探究和實驗設計,題目涉及氧化還原反應、離子方程式的書寫、離子檢驗、實驗基本操作等,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


 應用題點撥系列答案
應用題點撥系列答案 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:選擇題
| A. | 取樣,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取樣,先加鹽酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取樣,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取樣,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化學反應既屬于復分解反應又屬于氧化還原反應 | |
| D. | 常溫下,將pH=3的HA和PH=11的BOH等體積混合后pH>7,可能生成了弱酸強堿鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
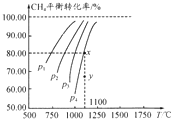 在一容積不變的密閉容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定條件下發生反應:CH4(g)+CO2(g)?2CO(g)+2H2(g).測得平衡時CH4的轉化率與溫度、壓強的關系如圖.下列有關說法正確的是( )
在一容積不變的密閉容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定條件下發生反應:CH4(g)+CO2(g)?2CO(g)+2H2(g).測得平衡時CH4的轉化率與溫度、壓強的關系如圖.下列有關說法正確的是( )| A. | 上述反應的△H<0 | |
| B. | 壓強P1>P2>P3>P4 | |
| C. | 1100℃時該反應的平衡常數約為1.64 | |
| D. | 壓強為P4時,y點的v正<v逆 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在化工生產中應遵循“綠色化學”的思想 | |
| B. | 在元素周期表的過渡元素中尋找優良的催化劑 | |
| C. | 汽車尾氣中產生NO的原因是空氣中的N2與O2在汽車汽缸內的高溫環境下發生反應的產物 | |
| D. | 根據元素周期律,由HClO4可以類推出氟元素也存在最高價氧化物的水化物HFO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C在反應中被還原 | B. | S和KNO3都發生了還原反應 | ||
| C. | CO2是反應的氧化產物 | D. | K2S和N2都是反應的還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電過程是化學能轉化為電能的過程 | |
| B. | 充電時陽極反應:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放電時負極附近溶液的酸性增強 | |
| D. | 放電時電解質溶液中的OH-向正極移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com