
分析 (1)尿素分子中C原子形成3個σ鍵、沒有孤對電子,雜化軌道數目為3,每個分子中含有7個σ鍵;
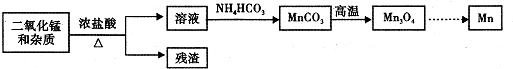
(1)鹽酸與二氧化錳在加熱條件下反應產生氯氣,濾液中含有氯化錳,加入碳酸銨可生成碳酸錳,經高溫生成Mn3O4,最后用熱還原法生成Mn.
①氯氣是有毒氣體,要保持通風,避免中毒;
②碳酸錳在空氣中灼燒時有氧氣參與反應,同時生成二氧化碳;
(3)①銅原子核外電子數為29,根據能量最低原理書寫電子排布式;與Cu同周期且原子序數最小的第Ⅷ族元素為Fe,其基態原子核外電子排布式為1s22s22p63s23p63d64s2;
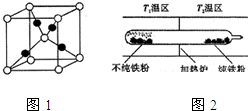
②根據均攤法計算晶胞中白色球、黑色球數目,結合化學式判斷晶胞中Cu、O原子數目,再計算晶胞質量,根據ρ=$\frac{m}{V}$計算晶胞密度;
(4)①綠礬變質時亞鐵離子被氧化為鐵離子,檢驗綠礬是否完全變質可以檢驗是否含有亞鐵離子;
②Fe( CO)的熔沸點低,應屬于分子晶體;
鐵粉和一氧化碳化合成羰基合鐵時放出熱量,低溫有利于合成易揮發的羰基合鐵,羰基合鐵易揮發,雜質殘留在玻璃管左端;當羰基合鐵揮發到高溫區T2時,即升溫平衡逆向移動,羰基合鐵分解,純鐵粉殘留在右端.
解答 解:(1)尿素分子的結構簡式為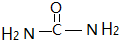 ,雜化軌道數目為3,所以尿素分子中碳原子的雜化方式為sp2雜化,每個分子中含有7個σ鍵,所以1mol尿素中含有7molσ鍵,含有的σ鍵數為7×6.02×1023,
,雜化軌道數目為3,所以尿素分子中碳原子的雜化方式為sp2雜化,每個分子中含有7個σ鍵,所以1mol尿素中含有7molσ鍵,含有的σ鍵數為7×6.02×1023,
故答案為:sp2;7×6.02×1023;
(2)鹽酸與二氧化錳在加熱條件下反應產生氯氣,濾液中含有氯化錳,加入碳酸銨可生成碳酸錳,經高溫生成Mn3O4,最后用熱還原法生成Mn.
①濃鹽酸與二氧化錳反應產生氯氣,氯氣是有毒氣體,要保持通風,避免中毒,反應方程式為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②碳酸錳在空氣中灼燒時有氧氣參與反應,同時生成二氧化碳,反應的方程式為6MnCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Mn3O4+6CO2,
故答案為:6MnCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Mn3O4+6CO2;
(3)①銅原子核外電子數為29,核外電子排布式為1s22s22p63s23p63d104s1,與Cu同周期且原子序數最小的第Ⅷ族元素為Fe,其基態原子核外電子排布式為1s22s22p63s23p63d64s2,3d能級有4個未成對電子,
故答案為:1s22s22p63s23p63d104s1;4;
②晶胞中白色球數目為1+8×$\frac{1}{8}$=2,黑色球數目為4,故白色球為O原子、黑色球為Cu原子,晶胞質量為$\frac{2×144}{{N}_{A}}$g,則晶胞密度為$\frac{2×144}{{N}_{A}}$g÷(a cm)3=$\frac{288}{{a}^{3}{N}_{A}}$g/cm3,
故答案為:$\frac{288}{{a}^{3}{N}_{A}}$;
(4)①綠礬變質時亞鐵離子被氧化為鐵離子,實驗檢驗綠礬是否完全變質方法為:取樣品溶于水,滴加酸性高錳酸鉀溶液,如溶液褪色,則表示樣品沒有完全變質(或滴加鐵氰化鉀溶液,產生藍色沉淀,則樣品沒有完全變質,
故答案為:取樣品溶于水,滴加酸性高錳酸鉀溶液,如溶液褪色,則表示樣品沒有完全變質(或滴加鐵氰化鉀溶液,產生藍色沉淀,則樣品沒有完全變質;
②Fe( CO)的熔沸點低,應屬于分子晶體;
鐵粉和一氧化碳化合成羰基合鐵時放出熱量,低溫有利于合成易揮發的羰基合鐵,羰基合鐵易揮發,雜質殘留在玻璃管左端;當羰基合鐵揮發到高溫區T2時,即升溫平衡逆向移動,羰基合鐵分解,純鐵粉殘留在右端,故T1<T2,
故答案為:分子晶體;鐵粉和一氧化碳化合成羰基合鐵時放出熱量,低溫有利于合成易揮發的羰基合鐵,羰基合鐵易揮發,雜質殘留在玻璃管左端;當羰基合鐵揮發到高溫區T2時,即升溫平衡逆向移動,羰基合鐵分解,純鐵粉殘留在右端,故T1<T2.
點評 本題考查化學工藝流程、實驗方案設計、晶胞計算、平衡移動原理應用、晶體類型與性質、核外電子排布、雜化方式等,實.驗拼合型題目,需要學生具備扎實的基礎與靈活應用能力,難度中等


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
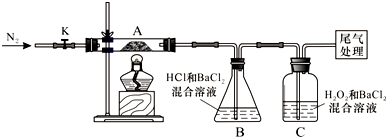
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
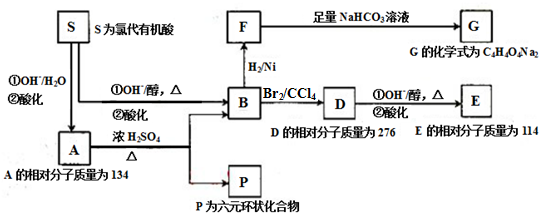
 .
.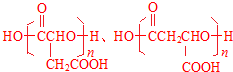 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 與足量Ca( OH)2溶液反應的離子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 與FeCI3溶液反應的離子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液藍色褪去,說明NaHSO3溶液具有漂白性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子數為0.1NA 的N2 和NH3 混合氣體,原子間含有的共用電子對數目為0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定條件下充分反應后,所得混合氣體的分子數大于2NA | |
| C. | 1.5 mol NO2 與足量水反應,轉移的電子數為1.5NA | |
| D. | 常溫條件下,分子數為NA 的CO、N2混合氣體質量為28 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W分子中碳、氫質量比為1:2 | B. | W同分異構體有5種 | ||
| C. | 經紅外光譜測定W最多有4個甲基 | D. | 在核磁共振氫譜中W最少有2個峰 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
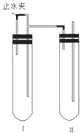 用下面兩種方法可以制得白色的Fe(OH)2沉淀.
用下面兩種方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
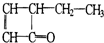 ,可表示為
,可表示為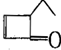 ,某有機物
,某有機物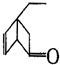 的多種同分異構體中,屬于芳香醇的一共有(不考慮立體異構)( )
的多種同分異構體中,屬于芳香醇的一共有(不考慮立體異構)( )| A. | 3種 | B. | 4種 | C. | 5種 | D. | 9種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com