
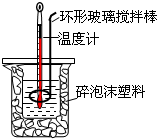
 測定中和熱實驗裝置如圖:
測定中和熱實驗裝置如圖:| 溫度實驗次數 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| Q |
| n |
| 5.12kJ |
| 0.08mol |
| 5.12kJ |
| 0.08mol |
| 4.0℃+3.9℃+4.1℃ |
| 3 |
| 1.3376KJ |
| 0.025mol |


科目:高中化學 來源: 題型:
| A、分子中的所有原子均達到8電子穩定結構 |
| B、分子中N-C1鍵鍵長與CCl4分子中C-Cl鍵鍵長相等 |
| C、NCl3分子是平面三角形非極性分子 |
| D、NBr3比NCl3易揮發 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、用CCl4可擦去圓珠筆油漬 |
| B、蜂蟻螯咬處涂抹稀氨水可減痛 |
| C、烹魚時加入少量食醋和黃酒來調味 |
| D、用食醋來除水壺里的水垢 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室用乙醇和濃硫酸加熱反應制取乙烯,其原理為:
實驗室用乙醇和濃硫酸加熱反應制取乙烯,其原理為:| 濃硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
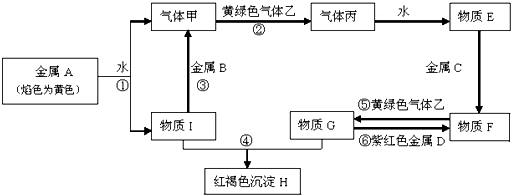
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com