
分析 (1)由亞硝酸鈉能使血紅蛋白中Fe2+轉化為高鐵血紅蛋白而使人發生急性中毒,則亞硝酸鈉具有氧化性,再由服用維生素C可解除NaNO2鹽中毒,則解毒過程中Fe元素的化合價降低,維生素C中某元素的化合價升高,誤食亞硝酸鈉中毒,可服維生素C緩解,說明維生素C具有還原性,以此來解答;
(2)6CeO2+18NH4F═6CeF3+16NH3↑+12H2O+N2↑反應中Ce 的化合價從+4價降低到+3價,N元素的化合價從-3價升高到0價,根據電子守恒計算.
解答 解:亞硝酸鈉能使血紅蛋白中Fe2+轉化為高鐵血紅蛋白而使人發生急性中毒,則亞硝酸鈉具有氧化性,是氧化劑,Fe2+被氧化,誤食亞硝酸鈉中毒,可服維生素C緩解,說明維生素C具有還原性,
故答案為:氧化;氧化;還原;
(2)6CeO2+18NH4F═6CeF3+16NH3↑+12H2O+N2↑反應中Ce 的化合價從+4價降低到+3價,則CeO2為氧化劑,N元素的化合價從-3價升高到0價,則NH4F為還原劑,反應中18molN原子參加反應,只有2molN原子被氧化,所以反應中被氧化的氮原子與未被氧化的氮原子物質的量之比為2:16=1:8;
故答案為:CeO2;NH4F;1:8.
點評 本題以信息的形式考查氧化還原反應,把握反應中元素的化合價變化為解答的關鍵,注意習題中信息的應用,側重氧化還原反應中基本概念的考查,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molFe溶于過量硝酸,電子轉移數為2NA | |
| B. | 1molN2與4molH2反應生成的NH3分子數為2NA | |
| C. | 標準狀況下,2.24LCCl4含有的共價鍵數為0.4NA | |
| D. | 14g乙烯和丙烯混合氣體中的氫原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
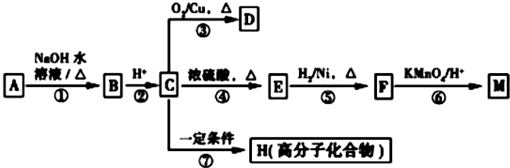
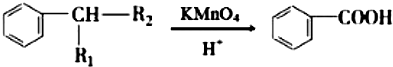 (R1、R2表示烴基或氫原子)
(R1、R2表示烴基或氫原子)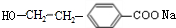 .
.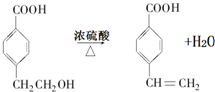 .
.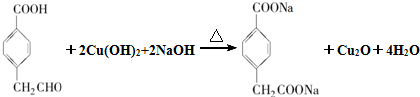 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
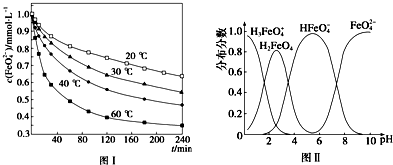
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
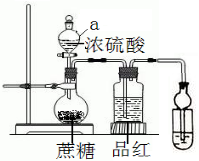 在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發燙,品紅溶液顏色變淡.請回答:
在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發燙,品紅溶液顏色變淡.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等體積混合后溶液的pH=3,則混合溶液中離子濃度的大小順序為:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等濃度的下列稀溶液:①硫酸氫鈉 ②乙酸鈉 ③醋酸 ④碳酸氫鈉 ⑤硝酸鈉 ⑥苯酚鈉,它們的pH由小到大排列為:③⑤①④②⑥ | |
| C. | 常溫下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的順序是:②>①>④>③ | |
| D. | 在25℃時,將a mol•L-1的氨水與0.01 mol•L-1的鹽酸等體積混合反應時溶液中c(NH4+)=c(Cl-).用含a的代數式表示NH3•H2O的電離常數Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com