
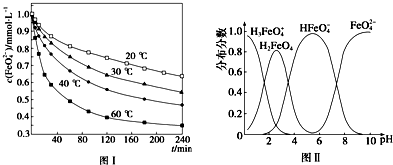
分析 (1)根據元素守恒和化合價的變化分析;高鐵酸鉀(K2FeO4)具有極強的氧化性,是一種優良的水處理劑,起到殺菌消毒作用,形成膠體具有吸附懸浮雜質的作用;
(2)溫度越高,相同時間內FeO42-濃度變化越快,高鐵酸鉀溶液平衡時FeO42-濃度越小;溫度越高FeO42-濃度越小,正向反應是吸熱反應;
(3)根據圖象的內容來分析圖象所描述的意義;
(4)平衡常數等于生成物濃度冪之積與反應物濃度冪之積的比.
解答 解:(1)根據元素守恒可知未知產物應含氧元素,反應中Fe元素化合價降低,則氧元素化合價升高,所以產物為氧氣,根據原子守恒可知為3O2;高鐵酸鉀(K2FeO4)具有極強的氧化性,是一種優良的水處理劑,起到殺菌消毒作用,形成膠體具有吸附懸浮雜質的作用;
故答案為:3O2↑;殺菌消毒、吸附懸浮物;
(2)由圖1數據可知,溫度越高,相同時間內FeO42-濃度變化越快,高鐵酸鉀溶液平衡時FeO42-濃度越小,溫度越高FeO42-濃度越小,正向反應是吸熱反應;
故答案為:溫度升高,反應速率加快,平衡向正反應方向移動;>;
(3)A、不同PH值時,溶液中鐵元素的存在形態及種數不相同,比如在PH值等于6時,就只有兩種形態,故A錯誤;
B.根據圖片知,改變溶液的pH,當溶液由pH=2變化至pH=10的過程中,HFeO4-的分布分數先增大后減小,故正確;
C.向pH=8的這種溶液中加KOH溶液,發生反應的離子方程式為:HFeO4-+OH-=FeO42-+H2O,故C錯誤;
故答案為:B;
(4)HFeO4-?H++FeO42-的電離平衡常數表達式為K=$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$,故答案為:$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$.
點評 本題考查了缺項方程式的配平、電離平衡、溫度對平衡的影響等知識點,題目難度中等,注意對圖象的分析是解題的關鍵.


 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:實驗題
| 物質 | 熔點/℃ | 沸點/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.
研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 組成物質分別是 | |||||
| 質 量 為(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
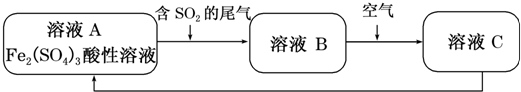
| A. | 向C溶液中滴加KSCN溶液,溶液變為血紅色 | |
| B. | 溶液B轉化為溶液C發生的變化的離子方程式為4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亞鐵可以使溶液C轉化為溶液A |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com