
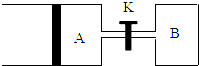
 按要求填空:
按要求填空:分析 (1)計算酸、堿的物質的量,判斷過量,再計算pH;
(2)計算出堿溶液混合后的c(OH-),根據Kw=c(OH-)×c(H+)=10-14可計算出c(H+),最后計算出溶液的pH;
(3)根據圖象知,A保持恒壓,B保持恒容,
①先根據相同條件下,氣體的氣體之比等于物質的量之比計算平衡后氣體的物質的量,再結合方程式計算X反應的物質的量,最后根據轉化率公式計算X的轉化率;
②結合B裝置中壓強對化學平衡的影響判斷X的轉化率大小;
③根據等溫、等壓條件下,氣體的體積之比等于物質的量之比,已知A中充入1molX和1molY的體積為1.2aL,則打開K,相當于充入了3molX和3molY,所以AB總體積為3.6aL,從而得出A的體積.
解答 解:(1)鹽酸是一元強酸,氫氧化鋇是二元強堿,將0.1mol/L鹽酸和0.06mol/L氫氧化鋇溶液等體積混合后,氫氧化鋇有剩余,該混合溶液中氫氧根離子濃度為:$\frac{0.06mol/L×2-0.1mol/L}{2}$=0.01mol/L,
則溶液中氫離子濃度為:$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,所以混合溶液的pH=-lg10-12=12,
故答案為:12;
(2)常溫下pH=9的Ba(OH)2溶液中c(OH-)=10-5mol/L,pH=12的KOH溶液中c(OH-)=10-2mol/L,
按4:1的體積比混合,c(OH-)=$\frac{4×1{0}^{-5}+1{0}^{-2}}{5}$mol/L≈0.2×10-2mol/L,
則c(H+)=$\frac{1×1{0}^{-14}}{0.2×1{0}^{-2}}$=5×10-12mol/L,該溶液的pH=-lg5×10-12=12-lg5=11.7,
故答案為:11.3;
(3)①等壓、等溫條件下,氣體的體積之比等于氣體的物質的量之比,2mol氣體時,體積為aL,達到平衡時,VA=1.2a L,所以平衡后混合氣體的物質的量是2.4mol,
設A物質反應了mmol,
X(g)+Y(g)?2Z(g)+W(g) 物質的量增多
1mol 1mol
nmol (2.4-2)mol
n=0.4
所以X物質的轉化率=$\frac{0.4mol}{1mol}$×100%=40%;
②B裝置是在等容條件下,反應向正反應方向移動時,混合氣體的物質的量增大,導致容器內氣體壓強增大,增大壓強能抑制X的轉化率,所以X的轉化率減小,所以B容器中X的轉化率比A小,
故答案為:>;
③當打開K時,整個裝置是在等溫、等壓條件下反應,使整個裝置中氣體的壓強與A裝置中的初始壓強相同時;向A中充入1molX和1molY達到平衡時,VA=1.2aL;當打開K時,AB中氣體共為3molX和3molY,由于整個裝置是在等溫、等壓條件下的反應,達到平衡狀態時,混合氣體的體積是3.6aL,其中B是aL,所以A為2.6aL,
故阿阿為:2.6a.
點評 本題考查了化學平衡的計算、溶液pH的計算,題目難度中等,明確化學平衡及其影響因素為解答關鍵,注意掌握溶液酸堿性與溶液pH的關系及計算方法,試題培養 留學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態 | |
| B. | 2min后,加壓會使正反應速率增大,逆反應速率減小,平衡正向移動 | |
| C. | 反應過程中A和B的轉化率之比為3:1 | |
| D. | 該條件下此反應的化學平衡常數的數值約為0.91 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.
研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 組成物質分別是 | |||||
| 質 量 為(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
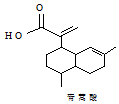
| A. | 青蒿酸的分子式為C15H20O2 | |
| B. | 1mol青蒿酸最多可與3molH2加成 | |
| C. | 青蒿酸與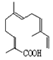 互為同分異構體 互為同分異構體 | |
| D. | 苯環上連有-CHO和-OH、分子中有6種不同化學環境氫的青蒿酸的同分異構體只有2種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com