
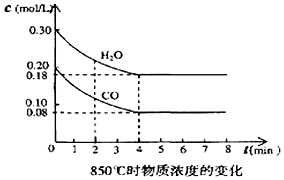
 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1| 時間/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1①
C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1②
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1③
將方程式$\frac{②-①-③}{2}$得CO(g)+H2O(g)?CO2(g)+H2(g)△H進行相應的改變;
(2)0~4min的平均反應速率v(CO)=$\frac{△c}{△t}$;根據方程式知,平衡時△c(CO)=△c(CO2)=△c(H2)=(0.20-0.08)mol/L=0.12mol/L,c(CO)=0.08mol/L,c(H2O)=0.18mol/L,化學平衡常數K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$;
(3)①表中3min-4min之間各物質的濃度不變,處于平衡狀態;850℃達到平衡時c(CO)=0.08mol/L,該反應為放熱反應,升高溫度逆向移動;
②反應在4min~5min,平衡向逆方向移動,根據平衡移動原理,結合選項判斷;
由表中數據可知,5min~6minCO的濃度降低,CO2濃度增大,濃度變化都是0.02mol/L,說明平衡向正反應移動,再結合水的濃度變化進行判斷.
解答 解:(1)O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1①
C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1②
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol-1③
將方程式$\frac{②-①-③}{2}$得CO(g)+H2O(g)?CO2(g)+H2(g)△H=$\frac{-393.5+483.6-172.5}{2}$kJ/mol=-41.2kJ•mol-1;
故答案為:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1;
(2)0~4min的平均反應速率v(CO)=$\frac{△c}{△t}$=$\frac{0.20-0.08}{4}$mol/(L.min)=0.03 mol/(L•min);根據方程式知,平衡時△c(CO)=△c(CO2)=△c(H2)=(0.20-0.08)mol/L=0.12mol/L,c(CO)=0.08mol/L,c(H2O)=0.18mol/L,化學平衡常數K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$=$\frac{0.08×0.18}{0.12×0.12}$=1;
故答案為:0.03 mol/(L•min);1;
(3)①在高于850℃時發生反應,化學反應速率加快,一定在4min前達到化學平衡.另外從表中可看出反應在3min和4min時的各物質濃度相同,故3min-4min之間反應應處于平衡狀態.由于是放熱反應,溫度升高,化學平衡向逆反應方向移動,C1數值應大于0.08 mol/L.
故答案為:平衡;大于;
②反應在4min-5min間,平衡向逆方向移動可能是升高溫度、增大生成物濃度、減少反應物濃度等因素引起,故選d.表中5min-6min之間CO濃度減少,H2O濃度增大,CO2濃度增大,只有增加水蒸氣,使化學平衡向正反應方向移動.故選a,
故答案為:d;a.
點評 本題考查化學平衡計算及外界條件對化學平衡移動的影響,為高頻考點,側重考查學生分析計算能力,將圖表信息和圖象信息相結合分析解答是解本題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題
| 沸點/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤ | B. | ①③⑤④② | C. | ①⑤④③② | D. | ①②⑤③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 測0.1 mol/L氨水的pH為11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃燒熱為-1559.9 kJ•mol-1,則乙烷燃燒的熱化學方程式可表示為:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃、101KPa時,16g O2和O3混合氣體中含有的原子數為NA | |
| B. | 1 mol NH3中含有的質子數為17NA | |
| C. | 11.2 L O2和N2的混合氣體含有的分子數為0.5NA | |
| D. | 金屬鐵與稀鹽酸反應當產生0.1 mol H2時轉移電子數為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K越大,反應達到平衡時所用的時間越短 | |
| B. | K越小,達到平衡時,反應物的 轉化率越大 | |
| C. | K隨反應物濃度改變而改變 | |
| D. | K越大,達到平衡時,反應進行的程度越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用澄清石灰水鑒別Na2CO3和NaHCO3溶液 | |
| B. | 用焰色反應鑒別NaCl和KCl | |
| C. | 用丁達爾效應鑒別硫酸鈉溶液和硅酸膠體 | |
| D. | 用排水集氣法收集NO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 水中溶解性 | |
| 異戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸異戊酯 | 130 | 0.8670 | 142 | 難溶 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com