
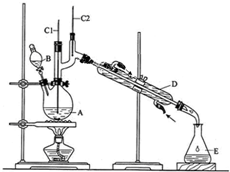
| 沸點/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
分析 (1)不能將Na2Cr2O7溶液加到濃硫酸中,因為濃硫酸的密度大,且溶于水時會放出大量的熱,容易發生迸濺;
(2)加入沸石的作用是防止暴沸,若加熱后發現未加沸石,應該冷卻后補加;
(3)B儀器的名稱是分液漏斗,D儀器的名稱直形冷凝管;
(4)分液漏斗使用前必須進行的第一項操作是檢漏;
(5)由表中數據可知,正丁醛密度小于水的密度,據此判斷;
(6)質譜儀可測定有機物的相對分子質量.
解答 解:(1)因為濃硫酸的密度大,且溶于水放出大量的熱,所以不能將Na2Cr2O7溶液加到濃硫酸中,否則容易發生迸濺,
故答案為:不能,因為濃硫酸的密度大,且溶于水放出大量的熱,容易發生迸濺;
(2)加入沸石的作用是防止暴沸,若加熱后發現未加沸石,應該冷卻后補加,
故答案為:防止暴沸;冷卻后補加;
(3)B儀器的名稱是滴液漏斗,D儀器的名稱直形冷凝管,
故答案為:滴液漏斗;直形冷凝管;
(4)分液漏斗使用前必須進行的第一項操作是檢漏,
故答案為:c;
(5)正丁醛密度為0.8017 g•cm-3,小于水的密度,故分層水層在下方,
故答案為:下;
(6)可利用質譜儀測定樣品的相對分子質量,如果為72,則可判斷樣品為純正丁醛,故答案為:利用質譜儀測定相對分子質量.
點評 本題考查有機化學實驗、反應原理、基本操作、化學計算等,難度不大,注意正丁醛與正丁醇的結構和性質差異及利用質譜儀測定相對分子質量,注意對基礎知識的理解掌握.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
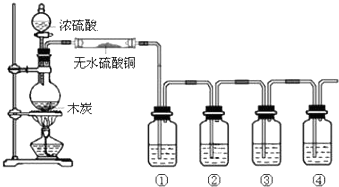
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
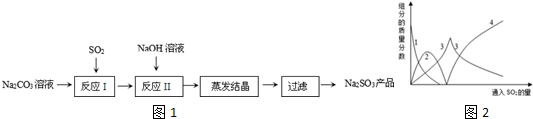
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
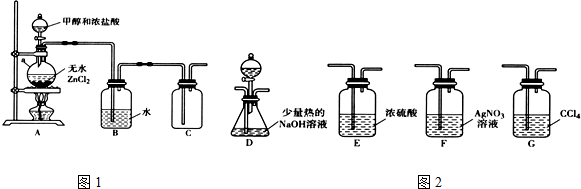
| 化學鍵 | C-Cl | C-Br |
| 鍵能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
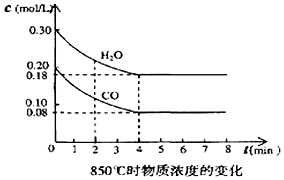 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1| 時間/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com