

分析 鈦鐵礦和濃硫酸反應的產物之一是TiOSO4,加入鐵屑,可防止Fe2+氧化,熱過濾后得濁液中含有FeSO4和TiOSO4,經冷卻再過濾,得晶體A為FeSO4•7H2O,濾液為TiOSO4溶液,溶液發(fā)生水解生成H2TiO3,經煅燒可生成TiO2,用氯氣、碳反應可生成TiCl4,高溫條件下與鎂反應可生成Ti,以此解答該題.
解答 解:鈦鐵礦和濃硫酸反應的產物之一是TiOSO4,加入鐵屑,可防止Fe2+氧化,熱過濾后得濁液中含有FeSO4和TiOSO4,經冷卻再過濾,得晶體A為FeSO4•7H2O,濾液為TiOSO4溶液,溶液發(fā)生水解生成H2TiO3,經煅燒可生成TiO2,用氯氣、碳反應可生成TiCl4,高溫條件下與鎂反應可生成Ti,
(1)加入鐵屑,可防止Fe2+氧化,發(fā)生的主要離子方程式為2Fe3++Fe=3Fe2+,
故答案為:2Fe3++Fe=3Fe2+;
(2)根據(jù)上面的分析可知,晶體A為FeSO4•7H2O,濁液需要冷卻的原因為降低溫度可減小的溶解度,便于結晶析出,方便分離出TiOSO4溶液,
故答案為:FeSO4•7H2O;降低溫度可減小的溶解度,便于結晶析出,方便分離出TiOSO4溶液;
(3)TiOSO4水解方程式為:TiOSO4+2H2O?H2TiO3↓+H2SO4,根據(jù)平衡移動原理,可采用加水、加堿等措施,促使平衡正向移動,以利于該反應順利進行,
故答案為:加水;加堿;
(4)TiO2可與焦炭、氯氣在1000~1100K溫度下反應,該反應中氧化劑為氯氣,還原劑為碳,若它們的物質的量相等,則反應的化學方程式為TiO2+2Cl2+2C$\frac{\underline{\;高溫\;}}{\;}$TiCl4+2CO,
故答案為:TiO2+2Cl2+2C$\frac{\underline{\;高溫\;}}{\;}$TiCl4+2CO;
(5)由于鈦、鎂在高溫下與空氣中的氧氣、二氧化碳等反應,所以工業(yè)上常用金屬鎂還原TiC14的方法制備Ti,需要在氬氣氛圍中,防止鈦、鎂在高溫下與空氣中的氧氣、二氧化碳等反應,
故答案為:防止鈦、鎂在高溫下與空氣中的氧氣、二氧化碳等反應.
點評 本題考查物質的制備實驗方案的設計,側重于學生的分析能力和實驗能力的考查,為高考常見題型,難度中等,注意把握實驗的基本原理和物質的性質.


 輕松課堂單元測試AB卷系列答案
輕松課堂單元測試AB卷系列答案 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 裝置圖 | 所盛試劑 | 實驗現(xiàn)象 | |
| 1 | 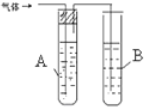 | A是 水 B是 酸性高錳酸鉀溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 保持溫度和活塞位置不變,在甲中再加入1 mol A和2 mol B,達到新的平衡后,甲中C的濃度是乙中C的濃度的2倍 | |
| B. | 保持活塞位置不變,升高溫度,達到新的平衡后,甲中B的體積分數(shù)增大,乙中B的體積分數(shù)減小 | |
| C. | 保持溫度不變,移動活塞P,使乙的容積和甲相等,達到新的平衡后,乙中C的體積分數(shù)是甲中C的體積分數(shù)的2倍 | |
| D. | 保持溫度和乙中的壓強不變,t2時分別向甲、乙中加入等質量的氦氣后,甲、乙中反應速率變化情況分別如圖2和圖3所示(t1前的反應速率變化已省略) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅和濃硝酸反應 | B. | 工業(yè)合成氨的反應 | ||
| C. | 工業(yè)制粗硅的反應 | D. | 銅和濃硫酸反應 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com