
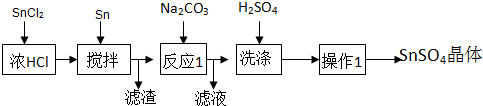
分析 SnCl2粉末加濃鹽酸進行溶解得到酸性溶液,此時溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+發生反應,使溶液酸性減弱,調節了溶液pH值,另外Sn可以將被氧化生成的Sn4+還原成Sn2+,即防止Sn2+被氧化為Sn4+,過濾得SnCl2溶液,向其中加碳酸鈉,將Sn元素以SnO形式沉淀,過濾洗滌得純凈的SnO,加稀硫酸,得SnSO4溶液,加熱濃縮、冷卻結晶、過濾、洗滌,制得SnSO4晶體;
(1)從溶液里獲得到晶體的實驗是結晶法
(2)由信息可知,SnCl2易水解生成堿式氯化亞錫,加入鹽酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除調節溶液pH外,還防止Sn2+被氧化;
(4)反應1是指碳酸鈉溶液和含Sn2+的溶液混合時發生了雙水解,生成SnO沉淀和CO2氣體;
(5)酸性條件下,SnSO4還可以用作雙氧水去除劑,雙氧水有強氧化性,將Sn2+易被氧化為Sn4+,自身被還原為水;
(6)用已知濃度的K2Cr2O7滴定生成的Fe2+,發生的反應為:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,根據電子轉移守恒與方程式可得關系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,據此計算.
解答 解:(1)從溶液里獲得晶體的系列實驗為蒸發濃縮、冷卻結晶、過濾、洗滌干燥,故答案為:蒸發濃縮、冷卻結晶、過濾、洗滌干燥;
(2)由信息可知,SnCl2易水解生成堿式氯化亞錫,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解,故答案為:SnCl2水解,發生SnCl2+H2O?Sn(OH)Cl+HCl,加入鹽酸,使該平衡向左移動,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除調節溶液pH外,還防止Sn2+被氧化,故答案為:防止Sn2+被氧化;
(4)CO32-和Sn2+發生雙水解反應的離子方程式為CO32-+Sn2+═SnO+CO2↑,故答案為:CO32-+Sn2+═SnO+CO2↑;
(5)酸性條件下,SnSO4還可以用作雙氧水去除劑,雙氧水有強氧化性,將Sn2+易被氧化為Sn4+,自身被還原為水,離子方程式為:Sn2++H2O2+2H+═Sn4++2H2O,故答案為:Sn2++H2O2+2H+═Sn4++2H2O;
(6)用已知濃度的K2Cr2O7滴定生成的Fe2+,發生的反應為:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,令錫粉中錫的質量分數為x,則:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7計算.
119g $\frac{1}{3}$mol
1.226g×x 0.100mol/L×0.032L
故$\frac{119g}{1.226x}=\frac{\frac{1}{3}mol}{0.100×0.032mol}$,解得x=93.2%,
故答案為:6、1、14、6、2、2、7H2O;93.2%.
點評 本題以SnSO4的制備為載體,考查學生對工藝流程的理解、物質的分離提純、閱讀題目獲取信息的能力、常用化學用語書寫、滴定應用及利用關系式進行的計算等,難度中等,對學生的基礎知識及邏輯推理有較高的要求.


 階梯計算系列答案
階梯計算系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | 該反應的平衡常數表達式為:K=[c(CH3OCH3)×c(H2O)]/c(CH3OH) | |
| B. | 此時正、逆反應速率的大小:v正<v逆 | |
| C. | 若加入CH3OH后,經10 min達到平衡,此時c(CH3OH)=0.04 mol/L | |
| D. | 10 min達到平衡時,反應速率v(CH3OH)=1.6 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在同溫同壓下,相同體積的任何氣體所含的原子數相同 | |
| B. | 相同條件下,N2和O2的混合氣體與等體積的N2所含原子數相等 | |
| C. | 等物質的量的NH4+和OH-所含質子數相等且電子數也相等 | |
| D. | 1mol 乙基中含有的電子數為18NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 牙膏 | 兩面針兒童牙膏 | 珍珠王防臭牙膏 | 中華透明牙膏 |
| 摩擦劑 | 氫氧化鋁 | 碳酸鈣 | 二氧化硅 |
| 摩擦劑的物質類別(指酸、堿、鹽、氧化物、兩性氫氧化物) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2LCO2與8.5gNH3所含分子數相等 | |
| B. | 等物質的量的H3O+和OH-質子數之比與電子數之比相同 | |
| C. | 常溫常壓下,48gO3和O2的混合氣體中含有的氧原子數為3NA | |
| D. | 標準狀況下,22.4LH2和Cl2的混合氣體中含有的分子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com