
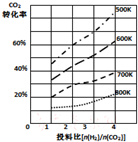
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.分析 (1)設反應的反應熱為xkJ•mol-1,根據甲醇的燃燒熱寫出:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-627kJ•mol-1 ,結合CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=xkJ•mol-1利用蓋斯定律可得:3H2(g)+$\frac{3}{2}$O2(g)=3H2O(l)△H=-627kJ•mol-1+kJ•mol-1,再依據焓變△H=反應物拆化學鍵吸收的能量-生成物形成化學鍵放出的能量計算得到;
(2)①根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積進行計算;
②根據溫度對平衡的影響分析△H的符號;平衡常數K只與溫度有關;
③當可逆反應達到平衡狀態時,正逆反應速率相等,反應體現中各物質的物質的量、物質的量濃度及百分含量都不變,以及由此引起的一些物理量不變,據此分析解答;
解答 解:(1)設反應的反應熱為xkJ•mol-1,根據甲醇的燃燒熱寫出:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-627kJ•mol-1 ,結合CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=xkJ•mol-1利用蓋斯定律可得:3H2(g)+$\frac{3}{2}$O2(g)=3H2O(l)△H=-627kJ•mol-1+xkJ•mol-1,即436kJ×3+496kJ×$\frac{3}{2}$-462kJ×6=-627kJ+xkJ,解得:x=-93;
故答案為:-93;
(2)①平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積,所以平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2})×{c}^{2}({H}_{2})}$,故答案為:$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2})×{c}^{2}({H}_{2})}$;
②因為溫度越高,CO2轉化率越小,則平衡逆移,所以該反應正方向為放熱反應,即△H<0,K只受溫度影響,若溫度不變,減小投料比,則K不變,
故答案為:<;不變;
③A.二氧化碳的濃度不變,則達到了平衡,故A選;
B.反應前后氣體的系數和不相等,當容器內壓強不再改變,則達到了平衡,故B選;
C.該反應是一個反應前后氣體體積變化的可逆反應,容器的體積不變,但反應前后氣體質量變化,氣體的密度不發生變化,則達到了平衡,故C選;
D.任何時候CH3OCH3與H2O的物質的量之比不變,不能說明反應達到平衡,故D不選;
故答案為:ABC.
點評 本題主要考查了化學平衡的判斷、化學平衡常數以及熱化學方程式的書寫,注意把握從鍵能的角度以及蓋斯定律計算反應熱的方法,第(1)問難度較大.


科目:高中化學 來源: 題型:解答題
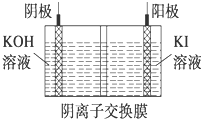 碘被稱為“智力元素”,科學合理地補充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘鹽中.
碘被稱為“智力元素”,科學合理地補充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘鹽中.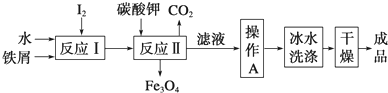
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
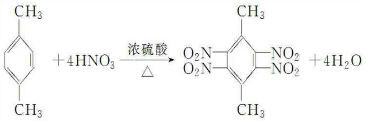 .
. 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
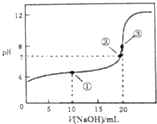 常溫下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲線如圖.下列說法正確的是( )
常溫下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲線如圖.下列說法正確的是( )| A. | 滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①處水的電離程度大于②處水的電離程度 | |
| C. | ②處加入的NaOH溶液恰好將CH3COOH中和 | |
| D. | ③處所示溶液:c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
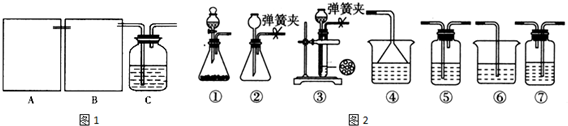
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
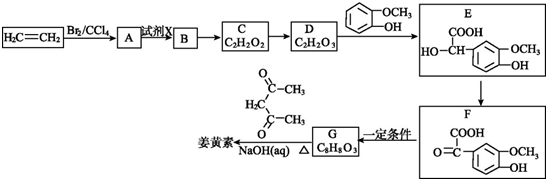
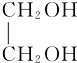 +O2$→_{△}^{Cu}$OHC-CHO+2H2O.
+O2$→_{△}^{Cu}$OHC-CHO+2H2O.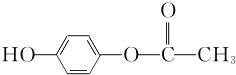 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
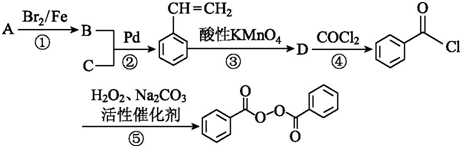
 ;
;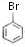 +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;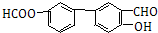 (苯環上基團位置可換);
(苯環上基團位置可換); )
)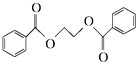 的流程圖,無機物任選,注明反應條件.
的流程圖,無機物任選,注明反應條件.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com