
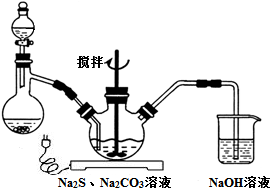
分析 Ⅰ.(1)制備二氧化硫用中等濃度的硫酸;
(2)Na2S2O3溶液中通入過量的二氧化硫發生反應生成單質硫和亞硫酸氫鈉;
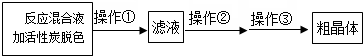
(3)硫代硫酸鈉的溶解度隨溫度的升高而降低,為減少損失,除去不溶性雜質需要趁熱過濾,濾液通過蒸發濃縮、冷卻結晶、抽濾、洗滌、干燥得到晶體;
Ⅱ.(4)依據化學方程式中的定量關系計算,2Na2S2O3+I2=2NaI+Na2S4O6;
(5)滴定過程中誤差分析可以依據C(待測)=$\frac{c(標準)V(標準)}{V(待測)}$分析,錯誤操作全部歸為標準溶液體積的變化判斷產生的誤差;
(6)取反應后的溶液少許滴入盛有10mL 0.1mol/L FeCl3溶液的小燒杯,溶液呈現血紅色,說明生成了SCN-.
解答 解:Ⅰ.(1)二氧化硫易溶于水,所以不能用稀酸,濃硫酸中氫離子濃度很小,不利于與亞硫酸鈉固體反應,所以制備二氧化硫用中等濃度的硫酸選C,
故答案為:C;
(2)pH小于7會引起Na2S2O3溶液的變質反應,會出現淡黃色混濁,反應的離子方程式是S2O32-+2H+=S↓+SO2↑+H2O,所以溶液pH要控制不小于7,反應約半小時,當溶液pH接近或不小于7時,即可停止通氣和加熱.如果通入SO2過量,發生的化學反應方程式為Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案為:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)由于硫代硫酸鈉的溶解度隨溫度的升高而降低,除去不溶性雜質,所以操作I應該是趁熱過濾,其目的是趁熱是為了防止晶體在過濾的過程中在漏斗中析出導致產率降低;過濾是為了除去活性炭、硫等不溶性雜質,操作②是溶液中獲得溶質晶體的操作為蒸發濃縮,冷卻結晶、抽濾、洗滌、干燥,得到粗晶體,
故答案為:趁熱是為了防止晶體在過濾的過程中在漏斗中析出導致產率降低;過濾是為了除去活性炭、硫等不溶性雜質; 蒸發濃縮,冷卻結晶;
Ⅱ.(4)取晶體樣品a g,加水溶解后,滴入幾滴淀粉溶液,用0.010mol/L碘水滴定到終點時,消耗碘水溶液 mL,結合化學方程式定量關系計算,
2Na2S2O3+I2=2NaI+Na2S4O6
2 1
n 0.010mol/L×v mL×1000L/ml
n=20vmol,
得到樣品純度=$\frac{20vmol×248g/mol}{ag}$×100%=$\frac{4960v}{a}$×100%,
故答案為:$\frac{4960v}{a}$×100%;
(5)A.錐形瓶未用Na2S2O3溶液潤洗,消耗標準溶液體積增大,測定結果偏高,故A錯誤;
B.錐形瓶中溶液變藍后立刻停止滴定,進行讀數,滴定可能為達到反應終點,消耗標準溶液體積減小,測定結果偏低,故B正確;
C.滴定終點時仰視讀數,讀取標準溶液體積增大,測定結果偏高,故C錯誤;
D.滴定管尖嘴內滴定前無氣泡,滴定終點發現氣泡讀取標準溶液體積減小,測定結果偏低,故D正確;
故答案為:BD;
Ⅲ.向裝有2mL 0.1mol/L 的NaCN溶液的試管中滴加2mL 0.1mol/L 的Na2S2O3溶液,兩反應物恰好完全反應,但無明顯現象,取反應后的溶液少許滴入盛有10mL 0.1mol/L FeCl3溶液的小燒杯,溶液呈現血紅色,說明生成SCN-離子,Na2S2O3解毒反應的離子反應方程式為:CN-+S2O32-=SCN-+SO32-,
故答案為:CN-+S2O32-=SCN-+SO32-.
點評 本題以實驗探究的方式考查物質的分離和提純方面的知識,屬于綜合知識的考查,注意知識的歸納和梳理是解題的關鍵,題目難度中等.


 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
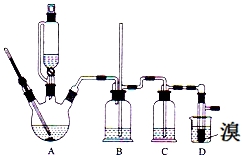 實驗室用少量的溴和足量的乙醇、濃硫酸制備1,2-二溴乙烷的裝置如圖所示,其中可能存在的主要副反應有:乙醇在濃硫酸的存在下在140℃脫水生成乙醚.有關數據列表如下:
實驗室用少量的溴和足量的乙醇、濃硫酸制備1,2-二溴乙烷的裝置如圖所示,其中可能存在的主要副反應有:乙醇在濃硫酸的存在下在140℃脫水生成乙醚.有關數據列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
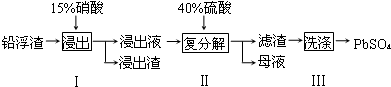
| 化學式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
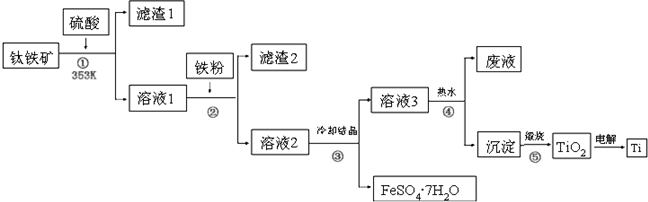
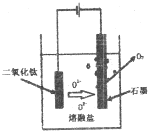
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
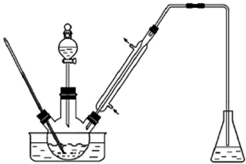 實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置主要部分如圖,相關物質的沸點見附表),附表相關物質的沸點(101kPa)
實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置主要部分如圖,相關物質的沸點見附表),附表相關物質的沸點(101kPa)| 物質 | 沸點/℃ | 物質 | 沸點/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 間溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl固體(KNO3)溶解配成熱飽和溶液、降溫結晶 | |
| B. | CO(水蒸氣)通過濃硫酸的洗氣瓶 | |
| C. | CaO固體(CaCO3)高溫煅燒 | |
| D. | KCl固體(MnO2)溶解、過濾、蒸發 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com