
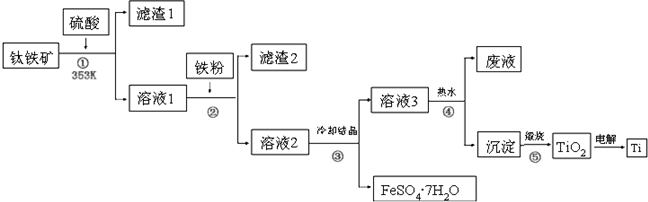
分析 鈦鐵礦的主要成分為鈦酸亞鐵(FeTiO3),FeTiO3溶于硫酸后Ti元素以TiO2+存在,過濾得到溶液1,溶液1中加入鐵粉還原鐵離子生成亞鐵離子過濾得到溶液2中含有TiO2+,FeSO4,冷卻結晶過濾得到硫酸亞鐵晶體和濾液3,在熱水中加熱析出沉淀H2TiO3,煅燒得到TiO2,電解TiO2 得到Ti,
(1)轉化關系中生成的離子分析判斷發生反應的物質和離子及其生成的離子,鐵還原鐵離子為亞鐵離子;
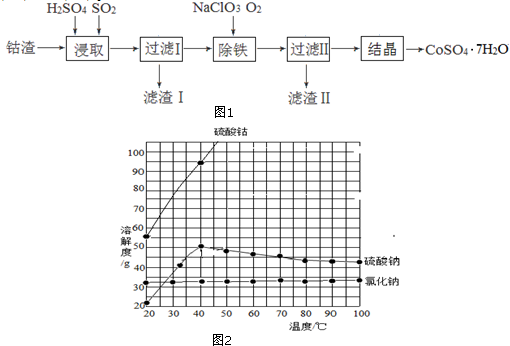
(2)根據物質溶解度本題分析析出晶體的條件應用;
(3)依據操作過程中形成的物質溶解性和分離目的分析回答;
(4)依據二氧化錳的氧化性氧化亞鐵離子分析氧化還原反應生成二價錳的化合物,結合電荷守恒和原子守恒寫出;
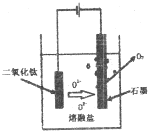
(5)依據圖示生成物質的分析,陽極生成二氧化碳,陰極析出鈣,結合電解池中陽極發生氧化反應,陰極發生還原反應,寫出電極反應;TiO2直接電解法生產鈦,發生還原反應,二氧化鈦為陰極,連接電源負極,由示意圖可知二氧化鈦獲得電子生成Ti與氧離子;電解一段時間后,需要更換石墨電極是因為氧離子生成氧氣會消耗碳.
解答 解:(1)步驟②中,用鐵粉將Fe3+轉化為Fe2+的反應的離子方程式為:2Fe3++Fe=3Fe2+,②中加入鐵粉的目的是除去Fe3+,
故答案為:除去Fe3+;
(2)步驟③冷卻結晶得到硫酸亞鐵晶體,利用的是物質溶解度的不同,通過冷卻熱飽和溶液得到,故答案為:b;
(3)②③④步驟的操作過程中都得到沉淀或晶體,所以需要過濾得到固體和溶液,
故答案為:過濾;
(4)④的離子方程式為:TiO2++2H2O=H2TiO3+2H+,④中使用熱水的目的是促進TiO2+水解生成H2TiO3,分離出固體加熱得到TiO2,該過程在熱水中操作的目的是由于水解反應吸熱,升高溫度有利于水解平衡向正反應方向移動,提高H2TiO3的產率,
故答案為:TiO2++2H2O=H2TiO3+2H+;由于水解反應吸熱,升高溫度有利于水解平衡向正反應方向移動,提高H2TiO3的產率;
(5)利用生產過程中的廢液與軟錳礦(主要成分為MnO2)反應生產硫酸錳(MnSO4,易溶于水),利用二氧化錳的氧化性氧化亞鐵離子為三價鐵離子,反應的離子方程式為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①電解時,陰極上得電子發生還原反應,所以二氧化鈦得電子生成鈦和氧離子,和電源負極相連,電極反應式為TiO2+4e-=Ti+2O2-;
故答案為:TiO2+4e-=Ti+2O2-;
②電解一段時間后,需要更換石墨電極,氧離子在陽極失電子發生氧化反應生成氧氣,碳和氧氣發生反應生成一氧化碳,反應為O2--2e-+C=CO,
故答案為:氧離子在陽極失電子發生氧化反應生成氧氣,碳和氧氣發生反應生成一氧化碳,O2--2e-+C=CO;
點評 本題考查了物質制備、物質性質、實驗基本操作、電解原理等知識點,掌握基礎是解題關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加入20 g 固體NaOH,攪拌、溶解 | |
| B. | 將溶液加熱濃縮至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀釋至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均勻 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由反應①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | 等物質的量的甲烷分別參與反應①、②,則反應轉移的電子數相等 | |
| C. | 若用標準狀況下4.48 L CH4還原NO2至N2,放出的熱量為173.4 kJ | |
| D. | 若用標準狀況下4.48 L CH4還原NO2至N2,整個過程中轉移的電子總數為3.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硝基苯的實驗室制備主要步驟如下:
硝基苯的實驗室制備主要步驟如下: .
. +3HNO3$→_{△}^{濃硫酸}$
+3HNO3$→_{△}^{濃硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | H2O分子中H-O的鍵能為462kJ?mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ?mol-1 | |
| C. | H2的燃燒熱為240 kJ?mol-1 | |
| D. | 欲分解2molH2O(l),至少需要提供4×462kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com