
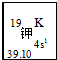
 我國的四大發明之一黑火藥,爆炸時反應的化學方程式為:S+2KNO3+3C→K2S+3CO2↑+N2↑.請根據其中所含的元素回答下列問題:
我國的四大發明之一黑火藥,爆炸時反應的化學方程式為:S+2KNO3+3C→K2S+3CO2↑+N2↑.請根據其中所含的元素回答下列問題: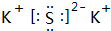 .
.分析 (1)K元素的相對原子質量為39.10,主族元素周期數=電子層數、主族族序最外層電子數;
(2)上述元素中S2-離子半徑最大,根據能量最低原理書寫其核外電子排布式,進而確定能級數目;亞硫酸與氯氣能反應且亞硫酸為二元弱酸;
(3)二氧化碳屬于非電解質,分子中C原子與O原子之間形成2對共用電子對;沸點最高是K2S,屬于離子化合物,由鉀離子與硫離子構成;
(4)同周期隨原子序數增大元素的非金屬性增強;根據同周期原子半徑從左到右依減小進行分析.
解答 解:(1)39.10是K元素的相對原子質量,K元素原子外圍電子排布為4s1,電子層數為4、最外層電子數為1,處于第四周期ⅠA族,
故答案為:K元素的相對原子質量;第四周期ⅠA族;
(2)上述元素中S2-離子半徑最大,其核外電子排布式為1s22s22p63s23p6,有5種不同能級的電子;亞硫酸與氯氣發生反應生成生成HCl與硫酸,亞硫酸是二元弱酸,電離方程式為:H2SO3?H++HSO3-,
故答案為:5;H2SO3?H++HSO3-;
(3)二氧化碳屬于非電解質;沸點最高是K2S,屬于離子化合物,由鉀離子與硫離子構成,其電子式為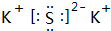 ,故答案為:CO2;
,故答案為:CO2;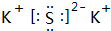 ;
;
(4)C、N、O同周期,同周期原子半徑從左到右依減小,原子核對核外電子的吸引力增強,得電子能力增強,非金屬性增強,故非金屬性O>N>C;
故答案為:O>N>C;同周期原子半徑從左到右依減小,原子核對核外電子的吸引力增強,得電子能力增強,非金屬性增強.
點評 本題考查元素周期表、元素周期律、常用化學用語、氧化還原反應等,難度不大,(2)為易錯點,學生容易想到硫酸而忽略亞硫酸.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 制備Fe(OH)3膠體:在加熱時,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提純含有少量溴的溴苯:向含有少量溴的溴苯中加入過量NaOH溶液充分振蕩后,靜置、分液,并除去有機相的水 | |
| D. | 比較AgCl、AgI的Ksp:向1 mL濃度均為2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在20g D2O中含有NA個氧原子 | |
| B. | 標準狀況下,2.24 L三氧化硫中所含氧原子數為0.3 NA | |
| C. | 1 molCl2參加反應轉移電子數一定為2NA | |
| D. | 含NA個Na+的Na2O溶解于1L水中,Na+的物質的量濃度為1 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子晶體 | B. | 分子晶體 | C. | 離子晶體 | D. | 金屬晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | α1<α2<α3<α4 | B. | α3<α2<α1<α4 | C. | α2=α3<α4<α1 | D. | α2=α3<α1<α4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度范圍/℃ | 固體質量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 摩爾任何物質都含NA個原子 | |
| B. | 0.1 mol/L K2SO4溶液中含有 K+為0.2 NA | |
| C. | 7.1gCl2與足量的氫氧化鈉溶液反應轉移的電子數一定為0.2NA | |
| D. | 標準狀況下,22.4L 以任意比混合的CO、CO2混合氣體所含碳原子數約為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com