

分析 (1)實(shí)驗(yàn)室利用二氧化錳與濃鹽酸加熱反應(yīng)制取氯氣,濃硫酸可以干燥氯氣;
(2)制取無(wú)水氯化亞鐵,需要HCl氣體,尾氣的成分是剩余HCl和生成的氫氣,HCl極易溶解于水,氫氣不能溶于水,據(jù)此解答即可;
(3)檢驗(yàn)氯化鐵常用硫氰化鉀溶液,若要制取純凈的FeCl2,需先點(diǎn)燃A處的酒精燈排除裝置中的空氣,據(jù)此解答即可.
解答 解:(1)制取無(wú)水氯化鐵的實(shí)驗(yàn)中,A裝置制取的是氯氣,實(shí)驗(yàn)室常用濃鹽酸與二氧化錳加熱制取,化學(xué)反應(yīng)方程式為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,裝置B的作用是干燥氯氣,常用濃硫酸,故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;濃硫酸;
(2)制取無(wú)水氯化亞鐵,需要HCl氣體,故A裝置制取的是HCl,反應(yīng)方程式為:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,故尾氣的成分為未反應(yīng)的HCl和生成的氫氣,由于HCl極易溶于水,故若仍然采用D裝置進(jìn)行尾氣處理,很容易造成倒吸,且氫氣不溶于水,不利于氫氣的吸收,氫氣易燃,造成安全隱患,故答案為:HCl;HCl和H2;發(fā)生倒吸;可燃性氣體H2不能被吸收;
(3)檢驗(yàn)氯化鐵常用硫氰化鉀溶液,若要制取純凈的FeCl2,需先排凈裝置中的空氣,故先點(diǎn)燃A處的酒精燈,再點(diǎn)燃C處的酒精燈,故答案為:KSCN;點(diǎn)燃A處的酒精燈;點(diǎn)燃C處的酒精燈.
點(diǎn)評(píng) 本題以氯化鐵以及氯化亞鐵的制取為載體,考查的是實(shí)驗(yàn)室中氯氣的制取方法、常見(jiàn)尾氣的處理方法以及鐵離子的檢驗(yàn)等,難度一般.



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:選擇題
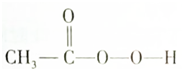 )是一種高效消毒劑,具有很強(qiáng)的氧化性和腐蝕性,它可由冰醋酸與過(guò)氧化氫在一定條件下制得;它可以迅速殺滅多種微生物,包括多種病毒、細(xì)菌和真菌.下列有關(guān)過(guò)氧乙酸的敘述中不正確的是( )
)是一種高效消毒劑,具有很強(qiáng)的氧化性和腐蝕性,它可由冰醋酸與過(guò)氧化氫在一定條件下制得;它可以迅速殺滅多種微生物,包括多種病毒、細(xì)菌和真菌.下列有關(guān)過(guò)氧乙酸的敘述中不正確的是( )| A. | 過(guò)氧乙酸溶液與碳酸鈣反應(yīng)能產(chǎn)生二氧化碳?xì)怏w | |
| B. | 過(guò)氧乙酸與乙醇能發(fā)生酯化反應(yīng) | |
| C. | 過(guò)氧乙酸與羥基乙酸(HOCH2COOH)互為同分異構(gòu)體 | |
| D. | 由過(guò)氧化氫與醋酸制取過(guò)氧乙酸的反應(yīng)屬于氧化還原反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | NO2 | B. | SO2 | C. | SO3 | D. | CO2 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題

 (或
(或
 );
);查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
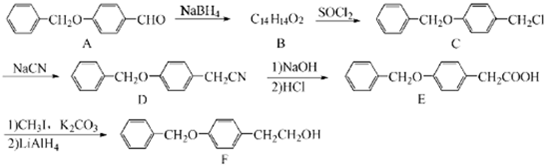
 ;由C→D的反應(yīng)類型是:取代反應(yīng).
;由C→D的反應(yīng)類型是:取代反應(yīng). .
. 為原料制備化合物X(結(jié)構(gòu)簡(jiǎn)式見(jiàn)圖)的合成路線流程圖(無(wú)機(jī)試劑可任選).合成路線流程圖示例如圖:CH3CHO$→_{催化劑△}^{O_{2}}$CH3COOH$→_{濃硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
為原料制備化合物X(結(jié)構(gòu)簡(jiǎn)式見(jiàn)圖)的合成路線流程圖(無(wú)機(jī)試劑可任選).合成路線流程圖示例如圖:CH3CHO$→_{催化劑△}^{O_{2}}$CH3COOH$→_{濃硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
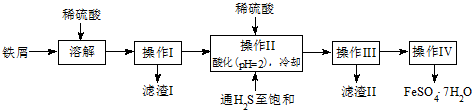
| 飽和H2S溶液 | SnS沉淀完全 | FeS開(kāi)始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com