

分析 淡化海水通入氯氣,氧化溴離子為單質溴,通入熱空氣或水蒸氣吹出Br2,用碳酸鈉溶液吸收溴單質,溴歧化為Br-和BrO3-,其離子方程式為3Br2+6CO32-+3H2O═5Br-+BrO3-+6HCO3-,然后加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的濃溶液,經萃取、蒸餾、分液,可得到液溴,以此解答.
(1)根據氯氣能氧化溴離子得到氯離子和單質溴書寫離子方程式;
(2)制備有毒氣體的實驗時,要及時將氣體排出,氯氣、溴單質有毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化鈉和溴酸鈉,同時放出CO2,NaBr化合價降低1,生成NaBrO3化合價升高5,根據化合價升降總數相等和質量守恒配平;(4)化合價升高元素失電子,所在反應物是還原劑,對應產物是氧化產物,化合價降低元素得到電子,所在反應物是氧化劑,對應產物是還原產物,化合價升高數=化合價降低數=轉移電子數;
(5)溴的濃溶液,經萃取、分液、蒸餾,可得到液溴;
(6)根據硫酸酸化的方程式5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O計算.
解答 解:(1)氯氣氧化性大于溴單質,氯氣可以氧化溴離子為溴單質,離子反應為:2Br-+Cl2═Br2+2Cl-,
故答案為:2Br-+Cl2═Br2+2Cl-;
(2)有毒氣體應有完全吸收處理裝置,氯氣、溴單質有毒,要在通風櫥中進行,為了防止中毒,要及時將氣體排出,
故答案為:防止中毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化鈉和溴酸鈉,同時放出CO2,該反應中Br元素化合價由0價變為-1價、+5價,其最小公倍數是5,再結合原子守恒得方程式為:3Br2+3Na2CO3═NaBrO3+5NaBr+3CO2↑,
故答案為:5NaBr;
(4)5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O中,NaBr中Br元素的化合價由-1價升高為0,為還原劑,NaBrO3中Br元素的化合價由+5價降低為0,為氧化劑,電子轉移情況為: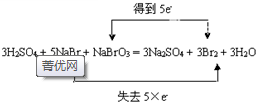 ,
,
故答案為: ;NaBrO3;
;NaBrO3;
(5)溴為易溶于有機溶劑的單質,溴的濃溶液,經萃取、分液、蒸餾,可得到液溴,
故答案為:分液;
(6)加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的濃溶液,每獲得1molBr2,需消耗1ol的硫酸,根據V(H2SO4)=$\frac{n}{c}$=$\frac{1mol}{5mol/L}$=0.2L,
故答案為:0.2L.
點評 本題考查混合物分離提純的綜合應用及海水提溴,為高頻考點,把握流程中的反應及混合物分離方法為解答的關鍵,側重分析與實驗能力的考查,題目難度中等.


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 試回答下列問題:
試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
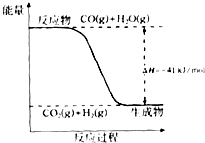 已知一氧化碳與水蒸氣反應過程的能量變化如圖所示:
已知一氧化碳與水蒸氣反應過程的能量變化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
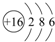 ;其最外層共有6種不同運動狀態的電子;
;其最外層共有6種不同運動狀態的電子;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;ZX與水反應放出氣體的化學方程式為NaH+H2O=NaOH+H2↑.
;ZX與水反應放出氣體的化學方程式為NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com