
 ,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大.
,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大.分析 (1)化學平衡常數,是指在一定溫度下,可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值;升高溫度平衡向吸熱的方向移動,據此判斷;
(2)正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大;
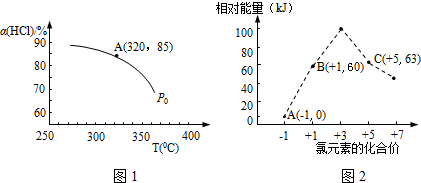
(3)設反應中氯化氫的起始的物質的量為amol,反應在P0、320°C條件下進行,達平衡狀態A時,氯化氫的轉化率為85%,即有85%amol的氯化氫反應生成氯氣的物質的量為$\frac{1}{2}$×85%amol=7.2×10-3mol,所以a=1.69×10-2mol,據此計算;
(4)a.增加n(HCl),平衡正向移動;
b.體積不變加入稀有氣體,各物質的濃度不變,所以平衡不移動;
c.壓強不變加入稀有氣體,則體積變大,相當于對原平衡體系減壓,則平衡向逆反應方向移動,據此判斷;
d.如果平衡常數K值增大,即平衡向正反應方向移動,即正反應速率大于逆反應的速率,由于該反應為放熱反應,所以要降低溫度,據此判斷;
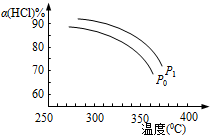
(5)B自身發生氧化還原反應生成A和D,根據轉移電子守恒得該反應方程式為3ClO-=ClO3-+2Cl-,反應熱=(62kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol,根據反應中氯元素的化合價的變化判斷轉移電子數.
解答 解:(1)O2+4HCl$?_{250~400℃}^{催化劑}$2Cl2+2H2O的平衡常數k=$\frac{c{\;}^{2}(Cl{\;}_{2})×c{\;}^{2}(H{\;}_{2}O)}{c{\;}^{4}(HCl)×c(O{\;}_{2})}$;升高溫度平衡向吸熱的方向移動,根據圖知,溫度升高,氯化氫的轉化下降,即平衡逆向移動,所以該反應的正反應為放熱反應,
故答案為:$\frac{c{\;}^{2}(Cl{\;}_{2})×c{\;}^{2}(H{\;}_{2}O)}{c{\;}^{4}(HCl)×c(O{\;}_{2})}$;放熱;
(2)正反應為氣體體積減小的反應,增大壓強,平衡向正反應方向移動,相同溫度下HCl的平衡轉化率比之前實驗的大,故壓縮體積使壓強增大,畫相應αHCl~T曲線的示意圖為 ,
,
故答案為: ,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大;
,增大壓強,平衡向正反應方向移動,αHCl增大,相同溫度下HCl的平衡轉化率比之前實驗的大;
(3)設反應中氯化氫的起始的物質的量為amol,反應在P0、320°C條件下進行,達平衡狀態A時,氯化氫的轉化率為85%,即有85%amol的氯化氫反應生成氯氣的物質的量為$\frac{1}{2}$×85%amol=7.2×10-3mol,所以a=1.69×10-2,所以平衡時容器中的n(HCl)=15%amol=2.54×10-3mol,
故答案為:2.54×10-3;
(4)a.增加n(HCl),平衡正向移動,即對正反應的反應速率影響更大,故a正確;
b.體積不變加入稀有氣體,各物質的濃度不變,所以平衡不移動,正逆反應速率 不變,故b錯誤;
c.壓強不變加入稀有氣體,則體積變大,相當于對原平衡體系減壓,則平衡向逆反應方向移動,所以正反應的反應速率下降得更多,故c錯誤;
d.如果平衡常數K值增大,即平衡向正反應方向移動,即正反應速率大于逆反應的速率,由于該反應為放熱反應,所以要降低溫度,所以逆反應速率下降得要比正反應速率多,故d正確;
故選ad;
(5)B→A+C,根據轉移電子守恒得該反應方程式為3ClO-=ClO3-+2Cl-,反應熱=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以該熱化學反應方程式為3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,根據方程式可知,每當有3mol的ClO-反應,可轉移電子4mol,所以若有1.5molClO-發生反應,轉移電子為2mol
故答案為:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;2.
點評 本題以氯元素為載體綜合考查元素化合物知識、反應熱的計算、氧化還原反應、化學平衡等知識點,綜合性較強,側重考查學生知識運用及圖象分析能力,難點是(5)題反應熱的計算,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 乙醇、糖類和蛋白質都是人體必需的營養物質 | |
| B. | 福爾馬林可防腐,可用它保存海鮮產品 | |
| C. | 油脂在酸性條件下水解生成高級脂肪酸和甘油 | |
| D. | 合成橡膠與光導纖維屬于有機高分子材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH5中既有共價鍵又有離子鍵 | |
| B. | NH5的電子式為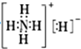 | |
| C. | 1 mol NH5中含有5NA個N-H鍵(NA表示阿伏加德羅常數) | |
| D. | 它與水反應的離子方程式為NH4++H-+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原溶液中不含HCO3-和CO32- | |
| B. | 向加鹽酸后的溶液中再加KSCN溶液,顯紅色 | |
| C. | 能確定原溶液中的五種離子 | |
| D. | 原溶液中有三種陽離子和兩種陰離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質是兩性物質 | |
| B. | 蛋白質分子中的重要化學鍵是肽鍵(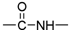 ) ) | |
| C. | 天然蛋白質水解的最終產物是α-氨基酸 | |
| D. | 蛋白質溶液中分別加入濃NaCl溶液、CuSO4溶液,其過程都是不可逆的 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 取少量樣品放入試管中,加熱,試管口放一團蘸有無水硫酸銅粉末的棉花團,變藍則可證明晶體的成分中一定含有結晶水 | |
| B. | 取少量樣品溶于水,向溶液中滴入幾滴新制氯水,再滴入2滴KSCN溶液,溶液變為紅色,則可證明晶體的成分中含有Fe2+ | |
| C. | 取少量樣品溶于水,滴入幾滴BaCl2溶液,有白色沉淀生成,則可證明晶體的成分中含有SO42- | |
| D. | 取少量樣品放入試管中,加入少量濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗,則可證明晶體的成分中是否含有NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
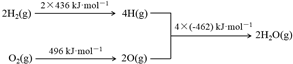
| A. | 1molC(s)完全燃燒放出110 kJ的熱量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ•mol-1 | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ•mol-1 | |
| D. | 欲分解2 mol H2O(l),至少需要提供4×462 kJ的熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com