
| A. | 燒杯①中,若構成微型電池,負極反應式為2Al-6e-=2Al3+,正極反應式為 6H++6e-=3H2↑ | |
| B. | 燒杯①中,若將電解質溶液換成濃硝酸,構成微型電池時鋁為負極,銅為正極 | |
| C. | 燒杯②中,若鐵、銅構成微型電池,則鐵為負極;若鋁、鐵構成微型電池,則鐵為正極 | |
| D. | 燒杯②中,固體最終完全溶解,溶液呈藍色.向溶液中滴加KSCN溶液,溶液不變色 |
分析 在燒杯①中,若構成微型電池,則鋁作負極,鐵或銅作正極,負極上鋁失電子發(fā)生氧化反應,正極上得電子發(fā)生還原反應,在燒杯②中,若構成原電池,則鋁或鐵作負極,則鐵或銅作正極,負極上活潑金屬失電子發(fā)生氧化反應,正極上氫離子得電子發(fā)生還原反應,據(jù)此分析.
解答 解:A.在燒杯①中,若構成微型電池,電解質溶液為氫氧化鈉,負極反應式為:2Al-6e-+8OH-=2AlO2-+4H2O,故A錯誤;
B.在燒杯①中,若將電解質溶液換成濃硝酸,鋁與濃硝酸發(fā)生鈍化反應,則鋁為正極,銅為負極,故B錯誤;
C.較活潑金屬為負極,則在燒杯②中,若鐵、銅構成微型電池,則鐵為負極;若鋁、鐵構成微型電池,則鐵為正極,故C正確;
D.稀硫酸與銅不反應,不可能生成硫酸銅,故D錯誤.
故選C.
點評 本題考查原電池原理,為高頻考點,側重于學生的分析能力的考查,注意在原電池中要注意電解質溶液的酸堿性與金屬的性質,要根據(jù)得失電子判斷正負極,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 在酸性條件下,CH3CO18OC2H5的水解產物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸和丙氨酸縮合最多可形成4種二肽 | |
| C. | 分子式為C5H8O2,既能與Na2CO3溶液反應又能與溴的四氯化碳溶液反應的有機物有8種 | |
| D. | 乳酸薄荷醇酯( )能發(fā)生水解、氧化、消去反應 )能發(fā)生水解、氧化、消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
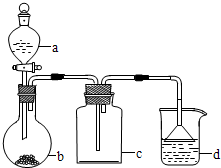
| 選項 | a種物質 | b種物質 | c種物質 | d中收集的氣體 |
| A | 濃氨水 | NaOH | 濃硫酸 | NH3 |
| B | 稀鹽酸 | CaCO3 | 濃硫酸 | CO2 |
| C | 稀硝酸 | Cu | 堿石灰 | NO |
| D | 濃鹽酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
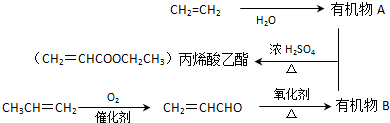
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

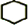 ,B名稱是1,2-二溴環(huán)己烷
,B名稱是1,2-二溴環(huán)己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$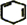 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 學生設計了下圖所示的方法對A鹽進行鑒定
學生設計了下圖所示的方法對A鹽進行鑒定| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定為AgCl沉淀 | D. | A一定為CuCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將硫酸銅溶液加熱蒸發(fā)、濃縮、冷卻結晶,可以制備硫酸銅晶體 | |
| B. | 測定等濃度NaClO溶液和Na2SO4溶液的pH,比較Cl、S元素的非金屬性強弱 | |
| C. | 萃取法除去NaBr溶液中的少量NaI,需要用燒杯、玻璃棒、膠頭滴管、分液漏斗 | |
| D. | 檢驗Na2SO3固體是否被部分氧化:取少量固體溶于水,滴加過量稀鹽酸,觀察是否產生氣泡,再滴加BaCl2溶液,觀察是否產生白色沉淀 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com