
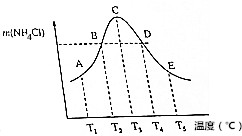
 ( )
( )| A. | 不同溫度下的平衡常數K3<K4<K5 | |
| B. | 正反應速率:vB=vD | |
| C. | 當體系氣體的平均相對分子質量不再改變時,不能說明反應達到平衡狀態 | |
| D. | A、B、D、E點均未達到平衡狀態,C點達到平衡狀態 |
分析 在容積相同的不同密閉容器內,分別充入等物質的量NH3和HCl,反應相同時間內,達到平衡狀態之前,溫度越高,反應速率越大,生成NH4Cl的質量增大,達到平衡后,升高溫度,NH4Cl的質量減小,說平衡向逆反應方向移動,故該反應是放熱反應.在圖中轉折點C為平衡狀態,轉折點左側(A、B)為平衡狀態之前,右側(D、E)為平衡移動到達新的平衡狀態.
解答 解:在容積相同的不同密閉容器內,分別充入等物質的量NH3和HCl,反應相同時間內,達到平衡狀態之前,溫度越高,反應速率越大,生成NH4Cl的質量增大,達到平衡后,升高溫度,NH4Cl的質量減小,說平衡向逆反應方向移動,故該反應是放熱反應.在圖中轉折點C為平衡狀態,轉折點左側(A、B)為平衡狀態之前,右側(D、E)為平衡移動到達新的平衡狀態.
A.升高溫度,平衡逆向移動,平衡常數減小,則平衡常數平衡常數K3>K4>K5,故A錯誤;
B.單位時間內生成氯化銨的質量相等,則正反應速率:vB=vD,故B正確;
C.平衡混合氣體中只有氨氣與HCl,二者起始物質的量之比為1:1,且按物質的量1:1反應,二者物質的量之比始終為1:1,氣體的平均相對分子質量始終不變,故C錯誤;
D.A、B未到達平衡,C點達到平衡狀態,D、E點達到平衡狀態,故D錯誤.
故選:B.
點評 本題考查化學平衡圖象、化學反應速率和化學平衡的影響因素,難度中等,關鍵是判斷C點是平衡點.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 molNa2O2和水完全反應,轉移電子數為2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+離子數為0.1 NA | |
| C. | 理論上氫氧燃料電池負極消耗11.2 L標準狀況下氣體,外線路通過電子數為NA | |
| D. | 常溫常壓下,28 g乙烯和丙烯混合氣體含有的碳原子總數為2.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 操作 | 現象與結論 | 離子方程式 |
| 第一步 | 取少量溶液裝于試管,向試管中加入幾滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,則溶液含有Fe2+;若無明顯變化,則不含Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1L0.1mol•L-1NaClO溶液中陰離子總數大于0.1NA | |
| B. | 7.8gNa2O2中含有的陰、陽離子總數是0.3NA | |
| C. | N2H2分子中各原子的最外層(除H外)均為8電子結構,1molN2H2中有共用電子對數目為3NA | |
| D. | 50mL18mol•L-1濃硫酸與足量銅反應,轉移電子數小于0.9NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com