
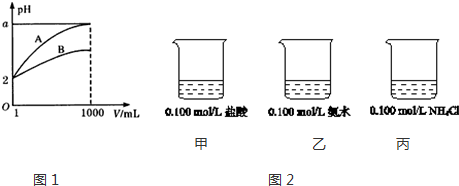
分析 圖1.
(1)pH=2的A、B兩種酸溶液各1mL,分別加水稀釋到1000mL,如果酸是強酸,則稀釋后溶液中氫離子濃度為10-5 mol/L,溶液的pH=5,如果pH<5,說明存在電離平衡,為弱酸;
(2)加水稀釋促進弱酸電離,稀釋后氫離子濃度減小但小于原來的$\frac{1}{1000}$;
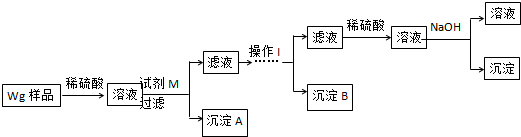
圖2.
(1)甲中HCl是強電解質,完全電離,氫離子濃度為0.01mol/L,根據pH=-lgc(H+)計算;
(2)甲和乙混合,二者恰好完全反應生成氯化銨,溶液體積增大一倍,所以混合后溶液中氯化銨濃度是丙中的一半;
(3)若將乙溶液全部倒入丙中,所得的混合溶液pH>7,說明一水合氨電離程度大于銨根離子水解程度導致溶液呈堿性,再結合電荷守恒判斷離子濃度大小.
解答 解:(1)稀釋弱酸時促進弱酸電離,則稀釋過程中pH變化越大的酸的酸性越強,變化越小的酸性越弱,根據圖象知,A是強酸、B是弱酸,若再稀釋100倍,酸溶液仍然呈酸性,但接近中性,所以A的pH<7,
故答案為:強;弱;<;
(2)若A、B都是弱酸,加水稀釋促進弱酸電離,所以稀釋1000倍后,溶液中氫離子濃度大于原來的$\frac{1}{1000}$,所以該溶液的pH范圍為:2<a<5,故答案為:2<a<5.
圖2.
(1)甲中HCl是強電解質,完全電離,氫離子濃度為0.01mol/L,pH=-lgc(H+)=-lg0.1=1,
故答案為:1;
(2)甲和乙混合,二者恰好完全反應生成氯化銨,溶液體積增大一倍,所以混合后溶液中氯化銨濃度是丙中的一半,故答案為:<;
(3)若將乙溶液全部倒入丙中,所得的混合溶液pH>7,說明一水合氨電離程度大于銨根離子水解程度導致溶液呈堿性,c(OH-)>c(H+),結合電荷守恒得c(NH4+)>c(Cl-),一水合氨電離和銨根離子水解程度都較小,所以離子濃度大小順序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案為:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
點評 本題考查弱電解質的電離,為高頻考點,側重考查學生分析及識圖能力,明確弱電解質電離特點及鹽類水解特點是解本題關鍵,注意守恒思想的靈活運用,易錯點是圖2中(2)題,二者混合導致溶液體積增大溶液的濃度降低,易忽略而導致錯誤.


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:選擇題
| A. | 3-氯戊烷的分子式為C6H9Cl3 | B. | 3-氯戊烷屬于烷烴 | ||
| C. | 3-氯戊烷的一溴代物共有3種 | D. | 3-氯戊烷的同分異構體共有6種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中導電粒子的數目增加,導電性增強 | |
| B. | 醋酸的電離程度增大,c(H+)減小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 稀釋后溶液pH=4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗原理 | m=cVM |
| 實驗儀器 | 托盤天平、藥匙、燒杯、玻璃棒、100mL容量瓶、膠頭滴管 |
| 實驗步驟 | (1)計算:溶質NaCl固體的質量為11.7g. (2)稱量:用托盤天平稱取所需NaCl固體. (3)溶解:將稱好的NaCl固體放入燒杯中,用適量蒸餾水攪拌. (4)轉移、洗滌:將燒杯中的溶液注入容量瓶中,并用少量蒸餾水洗滌燒杯內壁2~3次,洗滌液也都注入容量瓶中. (5)定容:將蒸餾水注入儀器至液面離刻度線1~2cm時,改用 膠頭滴管滴加蒸餾水至液面與刻度線相切. (6)搖勻:蓋好瓶塞,反復上下顛倒,然后靜置. |
| 思考與探究 | (7)某同學在實驗步驟(6)后,發現凹液面低于刻度線,于是再向容器中滴加蒸餾水至刻度線,該同學所配置溶液是濃度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl氣體都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸鈉溶液20mL與0.1mol•L-1鹽酸10mL混合后溶液顯酸性,則有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸與pH=10的氫氧化鈉溶液等體積混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,則該溶液中由水電離出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
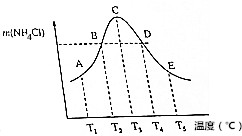 ( )
( )| A. | 不同溫度下的平衡常數K3<K4<K5 | |
| B. | 正反應速率:vB=vD | |
| C. | 當體系氣體的平均相對分子質量不再改變時,不能說明反應達到平衡狀態 | |
| D. | A、B、D、E點均未達到平衡狀態,C點達到平衡狀態 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com