
分析 在一密閉的2L容器中裝有4mol SO2和2mol O2,2min末測得容器中有0.8mol/L×2L=1.6mol SO2,則:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
變化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)根據c=$\frac{n}{V}$計算SO3的濃度;
(2)根據v=$\frac{△c}{△t}$計算v(SO3);
(3)SO2的轉化率=$\frac{轉化的量}{起始的量}$×100%.
解答 解:在一密閉的2L容器中裝有4mol SO2和2mol O2,2min末測得容器中有0.8mol/L×2L=1.6mol SO2,則:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
變化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)2min末SO3氣體的物質的量濃度為$\frac{2.4mol}{2L}$=1.2 mol/L,
答:2min末SO3氣體的物質的量濃度為1.2mol/L;
(2)2min內O2的平均反應速率v(O2)為$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol/(L.min),
答:2min內O2的平均反應速率v(O2)為0.3mol/(L.min);
(3)2min末SO2的轉化率為$\frac{2.4mol}{4mol}$×100%=60%,
答:2min末SO2的轉化率為60%.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法及反應速率公式、轉化率計算等為解答的關鍵,側重分析與計算能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl氣體都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸鈉溶液20mL與0.1mol•L-1鹽酸10mL混合后溶液顯酸性,則有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸與pH=10的氫氧化鈉溶液等體積混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,則該溶液中由水電離出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
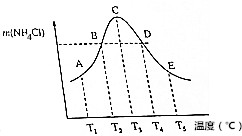 ( )
( )| A. | 不同溫度下的平衡常數K3<K4<K5 | |
| B. | 正反應速率:vB=vD | |
| C. | 當體系氣體的平均相對分子質量不再改變時,不能說明反應達到平衡狀態 | |
| D. | A、B、D、E點均未達到平衡狀態,C點達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (2)乙炔的結構式H-C≡C-H
(2)乙炔的結構式H-C≡C-H查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣態氫化物的穩定性:H2X<YH3<ZH4 | |
| B. | 最高價氧化物對應的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合價:X>Y>Z | |
| D. | 元素原子的半徑:X<Y<Z |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的數目為NA | |
| B. | 78g苯含有C=C雙鍵的數目為3NA | |
| C. | 常溫常壓下,14g由N2與CO組成的混合氣體含有的原子數目為NA | |
| D. | 6.72L NO2與水充分反應轉移的電子數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相對原子質量和電子數 | B. | 電子層數和最外層電子數 | ||
| C. | 電子層數和次外層電子數 | D. | 相對原子質量和最外層電子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 冰醋酸中H2SO4的電離方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 濃度均為0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com