
分析 (1)強堿性溶液中OH-能分別與NH4+、Al3+、反應,則溶液中不存在NH4+、Al3+;
①取少量的溶液用硝酸酸化后,該溶液無沉淀生成,則溶液中不含SiO32-;
②開始產生沉淀并逐漸增多,沉淀量基本不變后產生一種氣體,最后沉淀逐漸減少至消失,則存在AlO2-、CO32-;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,則含有氯離子;再結合溶液不顯電性來分析解答;
(3)根據實驗現象確定存在的離子并書寫離子方程式.
解答 解:(1)強堿性溶液中OH-能分別與NH4+、A13+、反應,則溶液中不存在NH4+、A13+;
①取少量的溶液用硝酸酸化后,該溶液無沉淀生成,因硅酸為沉淀,則溶液中不含SiO32-;
②開始產生沉淀并逐漸增多,沉淀量基本不變后產生一種氣體,最后沉淀逐漸減少至消失,則偏鋁酸根離子與酸反應生成沉淀,然后碳酸根離子與酸反應生成氣體,再沉淀與酸反應而溶解,所以原溶液中存在AlO2-、CO32-;又溶液不顯電性,則一定存在陽離子,即存在K+,
原溶液中肯定存在的是:AlO2-、CO32、K+、OH-,肯定不存在的是NH4+、A13+、SiO32-.
故答案為:AlO2-、CO32、K+、OH-;NH4+、A13+、SiO32-;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,則含有氯離子,故答案為:n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,則一定含有氯離子.
(3)試驗中生成沉淀的反應有:AlO2-+H++H2O=Al(OH)3↓,Ag++Cl-═AgCl↓,故答案為:AlO2-+H++H2O=Al(OH)3↓,Ag++Cl-═AgCl↓.
點評 本題考查了常見離子的檢驗,注意離子的特征離子反應以及現象、離子之間的干擾是關鍵,難度不大.


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:解答題
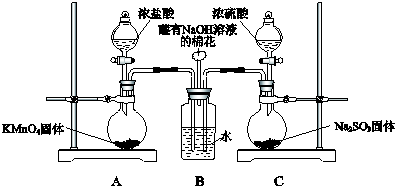
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
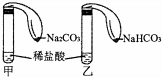 為對比Na2CO3與NaHCO3的性質,實驗小組的同學們在甲、乙兩支試管中分別加入足量稀鹽酸,將兩個分別裝有Na2CO3或NaHCO3粉末的小氣球分別套在兩支試管口.將氣球內的Na2CO3或NaHCO3倒入試管中(如圖).
為對比Na2CO3與NaHCO3的性質,實驗小組的同學們在甲、乙兩支試管中分別加入足量稀鹽酸,將兩個分別裝有Na2CO3或NaHCO3粉末的小氣球分別套在兩支試管口.將氣球內的Na2CO3或NaHCO3倒入試管中(如圖).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下NaHCO3比Na2CO3更 穩定 | |
| B. | 向等量的Na2CO3和NaHCO3固體中分別滴加同濃度的鹽酸,后者產生氣泡速率快 | |
| C. | 相同條件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 經實驗測定,Na2CO3溶液顯堿性,說明Na2CO3屬于堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
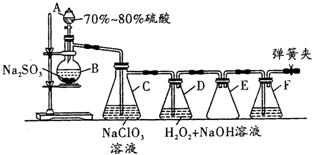 用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用如圖所示裝置(部分支持裝置省略)制備少量的亞氯酸鈉.
用二氧化氯(ClO2)可制備用途廣泛的亞氯酸鈉(NaClO2),實驗室可用如圖所示裝置(部分支持裝置省略)制備少量的亞氯酸鈉.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
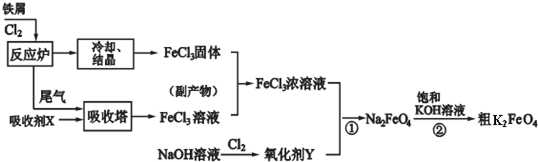
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為16、中子數為17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫離子(S2-)的結構示意圖: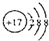 | |
| C. | 二硫化碳分子的結構式:S=C=S | |
| D. | 硫化氫分子的電子式: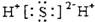 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 反應中NF3是氧化劑,H2O是還原劑 | |
| B. | 反應中被氧化與被還原的原子物質的量之比為2:1 | |
| C. | 若反應中生成0.2molHNO3,則反應共轉移0.4mol電子 | |
| D. | NF3在潮濕空氣中泄漏會產生紅棕色氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com