
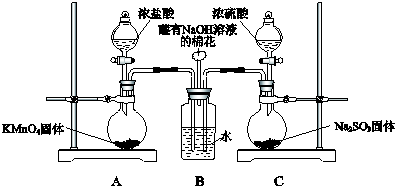
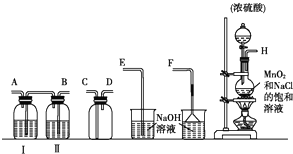
分析 (1)所含元素化合價降低的反應物為氧化劑;裝置C中濃硫酸與亞硫酸鈉反應生成硫酸鈉、二氧化硫與水;
(2)氯氣與二氧化硫有毒,會污染空氣,用氫氧化鈉吸收剩余氯氣或二氧化硫;
(3)①二氧化硫和氯氣發生氧化還原反應生成了氯化氫,氯離子遇到銀離子生成白色沉淀;
②制備氯氣中含有氯化氫和水蒸氣,氯化氫進入B中溶于水也會生成氯離子,需要在A、B間增加一個盛放飽和食鹽水的洗氣瓶,除去HCl;
③二氧化硫與氯氣在溶液中反應生成HCl與硫酸,硫酸根與銀離子也可以得到白色沉淀,檢驗硫酸根離子證明二氧化硫和氯氣發生了反應.
解答 解:(1)反應中KMnO4中Mn元素化合價降低,則KMnO4是氧化劑,裝置C中濃硫酸與亞硫酸鈉反應生成硫酸鈉、二氧化硫與水,反應方程式為:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,
故答案為:KMnO4;H2SO4+Na2SO3=Na2SO4+SO2↑+H2O;
(2)氯氣與二氧化硫有毒,直接排放會污染空氣,裝置B中蘸有NaOH溶液的棉花的作用是吸收剩余氯氣或二氧化硫,
故答案為:吸收剩余氯氣或二氧化硫;
(3)①二氧化硫和氯氣發生氧化還原反應生成了HCl,氯離子遇到銀離子生成白色沉淀,向其中滴加少量AgNO3溶液,有白色沉淀生成,甲同學由此認為SO2和Cl2發生了反應的依據是氯氣被還原為Cl-,
故答案為:Cl-;
②制備氯氣中含有氯化氫和水蒸氣,氯化氫進入B中溶于水也會生成氯離子,乙同學認為Cl2中混有的雜質是HCl,需要在A、B間增加一個盛放飽和食鹽水的洗氣瓶,除去HCl;
故答案為:HCl;飽和食鹽水;
③二氧化硫與氯氣在溶液中反應生成HCl與硫酸,硫酸根與銀離子也可以得到白色沉淀,檢驗硫酸根離子證明二氧化硫和氯氣發生了反應,
a.氯化鋇溶液可以檢驗硫酸根離子存在,證明二氧化硫和氯氣發生了反應,故a正確;
b.氫氧化鋇和二氧化硫反應生成亞硫酸鋇沉淀,不能說明二氧化硫和氯氣發生反應,故b錯誤;
c.硝酸鋇溶液中存在硝酸根離子,二氧化硫在溶液中被氧化為硫酸,也會生成硫酸鋇沉淀,不能說明二氧化硫和氯氣反應,故c錯誤;
d.氯氣和二氧化硫按照1:1通入品紅溶液反應,品紅溶液不褪色,沒有白色沉淀生成,不能證明生成硫酸根,故d錯誤;
SO2與Cl2同時通入水中反應的化學方程式是:SO2+Cl2+2H2O═2HCl+H2SO4
故答案為:a;SO2+Cl2+2H2O═2HCl+H2SO4.
點評 本題考查氣體制備與性質探究實驗,側重考查學生對實驗原理的分析評價、離子檢驗等,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 元素原子得電子能力:W<X<Y<Z | B. | 原子最外層電子數::W<X<Y<Z | ||
| C. | 原子半徑:W>X>Y>Z | D. | 元素的最高化合價:W<X<Y<Z |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在下面的裝置中,A是Cl2發生裝置,C、D為氣體的凈化裝置,E是硬質玻璃管中裝有細鐵絲網;F為干燥的廣口瓶,燒杯G為尾氣吸收裝置.試回答:
在下面的裝置中,A是Cl2發生裝置,C、D為氣體的凈化裝置,E是硬質玻璃管中裝有細鐵絲網;F為干燥的廣口瓶,燒杯G為尾氣吸收裝置.試回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
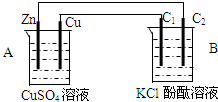
| A. | Zn為正極,Cu為負極,CuCl2溶液作電解質溶液 | |
| B. | Cu為正極,Zn為負極,稀H2SO4作電解質溶液 | |
| C. | Cu為正極,Zn為負極,CuSO4溶液作電解質溶液 | |
| D. | Fe為正極,Zn為負極,ZnSO4溶液作電解質溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 按如圖裝置進行實驗,并回答下列問題
按如圖裝置進行實驗,并回答下列問題查看答案和解析>>
科目:高中化學 來源: 題型:解答題
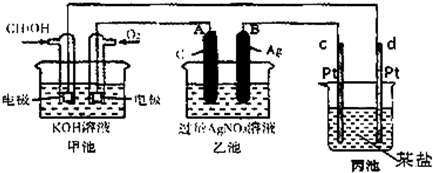
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 預期現象和結論 | |
| ① | 取少量上述漂白粉于試管中,加入適量1mol/L鹽酸溶解后,再將產生的氣體導入澄清石灰水中. | (1)若澄清石灰水未見渾濁,則假設1成立; (2)若澄清石灰水變渾濁,則假設2或3成立. |
| ② | 向步驟①反應后的試管中滴入1~2滴品紅溶液,振蕩(或另外取樣操作) | 結合實驗①中的(2), (1)若品紅褪色,則假設3成立; (2)若品紅不褪色,則假設2成立. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com