
| A. | 電池工作時,鋅失去電子,電解液內部OH-向負極移動 | |
| B. | 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 電池工作時,電子由正極通過外電路流向負極 | |
| D. | 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g |
分析 根據電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反應中Zn被氧化,失電子,為原電池的負極,負極反應為Zn-2e-+2OH-═Zn(OH)2,MnO2為原電池的正極,發生還原反應,正極反應為2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),結合離子、電子移動來分析解答該題.
解答 解:A、根據總反應可知Zn失電子被氧化,為原電池的負極,電解質溶液中陰離子向負極移動,故A正確;
B、根據電池總反應式為:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),MnO2為原電池的正極,發生還原反應,正極反應為2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B正確;
C、原電池中,電子由負極經外電路流向正極,故C錯誤;
D、負極反應為Zn-2e-+2OH-═Zn(OH)2,外電路中每通過O.2mol電子,消耗的Zn的物質的量為0.1mol,質量為0.1mol×65g/mol=6.5g,故D正確.
故選C.
點評 本題考查化學電源的工作原理,題目難度不大,注意電極反應方程式的書寫和判斷,側重于考查學生對基礎知識的應用能力和計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 放電時,OH-向負極方向移動 | |
| B. | 放電時,正極反應式為Zn+2OH--2e-═ZnO+H2O | |
| C. | 充電時,Zn發生氧化反應 | |
| D. | 充電時,陰極附近PH 減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
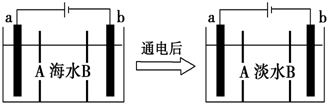
| A. | A膜是陽離子交換膜(只允許陽離子通過) | |
| B. | 通電后,海水中陰離子往b電極處運動 | |
| C. | 通電后,a電極的電極反應為4OH-4e-═O2↑+2H2O | |
| D. | 通電后,b電極上產生無色氣體,溶液中出現少量白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作步驟 | 預期現象與結論 |
| 步驟1:觀察樣品 | 溶液呈藍綠色,①不能(填“能”或“不能”)確定產物中鐵元素的價態 |
| 步驟2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫紅色褪去或變淺,說明產物中含+2價鐵元素,若KMnO4溶液不褪色或紅色不變淺,說明產物中不含+2價鐵元素 |
| 步驟3:③另取少量溶液,滴加KSCN溶液 | 若溶液變為紅色,說明產物中含+3價的鐵元素;若溶液顏色無明顯變化,則說明產物中不含+3價的鐵元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
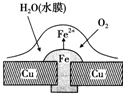
| A. | 正極的電極反應為:2H++2e-═H2↑ | |
| B. | 此過程中還涉及反應:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此過程中銅并不被腐蝕 | |
| D. | 此過程中電子從Fe移向Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| NO | N2 | CO2 | |
| 起始濃度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡濃度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次達到平衡測得容器中NO、N2、CO2的濃度值比為5:3:3,則△H<0(填“>”、“=”或“<”).
,再次達到平衡測得容器中NO、N2、CO2的濃度值比為5:3:3,則△H<0(填“>”、“=”或“<”).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| a轉化為b | a轉化為c | c轉化為b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com