
| NO | N2 | CO2 | |
| 起始濃度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡濃度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次達到平衡測得容器中NO、N2、CO2的濃度值比為5:3:3,則△H<0(填“>”、“=”或“<”).
,再次達到平衡測得容器中NO、N2、CO2的濃度值比為5:3:3,則△H<0(填“>”、“=”或“<”).分析 (1)③-①-②得2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l),依據蓋斯定律計算反應熱,寫出反應的熱化學方程式;
(2)①依據化學平衡狀態的實質是正逆反應速率相等,結合反應特征分析判斷;
②依據圖表數據分析,結合平衡濃度計算平衡常數和濃度變化分析判斷;
(3)①電解池中發生氧化反應的一極為陽極,陽極與電源正極相連,依據裝置圖可知二氧化硫在左邊失去電子發生氧化反應,據此判斷;
②依據在堿性條件下,陰極排出的溶液為S2O42-,二氧化氮與其發生反應生成氮氣和硫酸根離子,據此解答.
解答 解:(1)①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
則:③-①-②得2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l),依據蓋斯定律得:△H=-957 kJ•mol-1;
故NO2與CH4轉化成N2和H2O(l)的熱化學方程式為:2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957 kJ•mol-1;
故答案為:2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957 kJ•mol-1;
(2)①a反應速率之比等于化學方程式系數之比,當v正(NO)=2v逆(N2),反應達到平衡,v正(NO)=2v正(N2)則:v正(NO)=v逆(NO)可以判斷該反應達到平衡狀態的標志,故正確;
b可逆反應達到平衡時,各種物質的濃度保持不變,N2的濃度保持不變可以判斷該反應達到平衡狀態的標志,故正確;
c反應是氣體體積不變的反應,反應過程中和反應平衡狀態壓強相同,所以容器內壓強保持不變不能說明反應達到平衡,故錯誤;
d容器內CO2的體積分數不變,說明反應達到平衡,故正確;
故選:abd;
②依據圖中數據可知:改變條件前各物質濃度之比為4:3:3,若平衡后升高溫度,再次達到平衡測得容器中NO、N2、CO2的濃度值比為5:3:3,則說明平衡向逆向移動,逆向為吸熱反應,則正向為放熱反應,故△H<0;
故答案為:<;
(3)①依據裝置圖可知二氧化硫在左邊失去電子發生氧化反應生成硫酸根離子,電極反應式為:SO2+2H2O-2e-=SO42-+4H+,電解池中發生氧化反應的一極為陽極,陽極與電源正極相連,所以a為正極;
故答案為:正極;SO2+2H2O-2e-=SO42-+4H+;
②陰極排出的溶液為S2O42-,二氧化氮與其發生反應,S2O42-中硫元素由+3價,變為硫酸根中硫元素為+6價,S2O42-被氧化是還原劑;二氧化氮中的氮元素化合價為+4價變為氮氣0價,二氧化氮被還原為氧化劑,發生的離子方程式為S2O42-+NO2+OH-→SO42-+N2+H2O,依據原子守恒和得失電子守恒可得S2O42-系數為2,NO2系數為3,所以該反應中氧化劑與還原劑的物質的量之比為3:2;
故答案為:3:2.
點評 本題為綜合題,涉及反應熱的計算、熱化學方程式的書寫,化學平衡狀態的判斷,化學平衡移動的影響因素,電解原理的分析應用等,題目難度中等,側重于考查學生的分析能力和對基礎知識的綜合應用能力,掌握基礎是解題關鍵.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:解答題
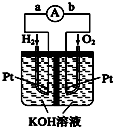 在能源日趨緊張的今天,科學工作者一直在研究如何提高現有化石能源的利用率,同時尋找開發清潔可再生能源.常采用的方法有煤的氣化、煤的液化、設計燃料電池等.
在能源日趨緊張的今天,科學工作者一直在研究如何提高現有化石能源的利用率,同時尋找開發清潔可再生能源.常采用的方法有煤的氣化、煤的液化、設計燃料電池等.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電池工作時,鋅失去電子,電解液內部OH-向負極移動 | |
| B. | 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 電池工作時,電子由正極通過外電路流向負極 | |
| D. | 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MOH能被醋酸中和 | |
| B. | 用MOH溶液做導電性實驗,燈泡亮度較暗 | |
| C. | MOH可使酚酞試液變紅 | |
| D. | 常溫時0.1mol•L-1MOH溶液的pH約為11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨工業溫度選擇為700K左右,只要是為了提高NH3產率 | |
| B. | 使用催化劑和施加高壓,都能提高反應速率,但對化學平衡狀態無影響 | |
| C. | 合成氨生產過程中將NH3液化分離,可提高N2、H2的轉化率 | |
| D. | 合成氨工業中為了提高氫氣的利用率,可適當增加氫氣濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 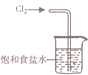 用裝置吸收多余的氯氣 | B. | 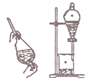 裝置用酒精萃取分離水中的碘 | ||
| C. | 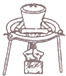 用裝置除去純堿中的小蘇打 | D. |  用裝置排水法收集氨氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 現象或事實 | 解釋 |
| A | 鋁箔在酒精燈上加熱,溶化后的液態鋁不滴落 | 高熔點的氧化鋁薄膜兜在鋁的外面,阻止了液態鋁滴落 |
| B | 漂白粉在空氣中久置變質 | 漂白粉中的CaCl2與空氣中的CO2反應生成CaCO3 |
| C | 鐵放在冷濃硝酸中不溶解,無紅棕色氣體產生 | 鐵遇濃硝酸鈍化,表面形成致密的氧化膜,阻止內部鐵繼續與硝酸反應 |
| D | Na著火不能用水滅火 | Na遇水劇烈反應,易引發爆炸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com