
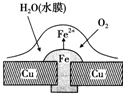
| A. | 正極的電極反應為:2H++2e-═H2↑ | |
| B. | 此過程中還涉及反應:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此過程中銅并不被腐蝕 | |
| D. | 此過程中電子從Fe移向Cu |
分析 根據圖片知,水中溶解了氧氣,銅、鐵和水構成了原電池,較活潑的金屬作負極,較不活潑的金屬作正極,發生吸氧腐蝕,負極上鐵失電子發生氧化反應,正極上氧氣得電子發生還原反應生成氫氧根離子,亞鐵離子與氫氧根離子結合生成氫氧化亞鐵,氫氧化亞鐵被氧氣氧化為氫氧化鐵,原電池放電時,電子從負極流向正極,據此分析.
解答 解:根據圖片知,水中溶解了氧氣,銅、鐵和水構成了原電池,較活潑的金屬作負極,較不活潑的金屬作正極,發生吸氧腐蝕.
A、中性或弱堿性條件下,氧氣得電子生成氫氧根離子,則正極上的電極反應式為:O2+2H2O+4e-=4OH-,故A錯誤;
B、負極上發生的電極反應式為:Fe-2e-=Fe2+,正極上的電極反應式為:O2+2H2O+4e-=4OH-,亞鐵離子和氫氧根離子反應生成氫氧化亞鐵,氫氧化亞鐵不穩定,容易被空氣中的氧氣氧化生成氫氧化鐵,反應方程式為:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正確;
C、該原電池中銅作正極,原電池放電時,負極失電子容易被腐蝕,正極被保護,所以銅不被腐蝕,故C正確;
D、該原電池放電時,外電路上電子從負極鐵流向正極銅,故D正確;
故選A.
點評 本題以原電池原理為載體考查了金屬的腐蝕,難度不大,明確鋼鐵發生析氫腐蝕和吸氧腐蝕的條件是解本題的關鍵,注意鋼鐵的吸氧腐蝕中還含有氫氧化亞鐵生成氫氧化鐵的反應.


科目:高中化學 來源: 題型:解答題
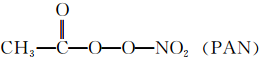 等二次污染物.
等二次污染物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 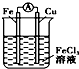 裝置是原電池,總反應是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  裝置研究的是金屬的析氫腐蝕,Fe上的反應為Fe-2e-═Fe2+ | |
| C. | 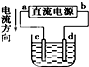 若用裝置精煉銅,則d極為粗銅,c極為純銅,電解質溶液為CuSO4溶液 | |
| D. | 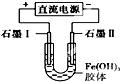 裝置通電一段時間后石墨Ⅱ電極附近溶液紅褐色加深 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鈦(Ti)被稱為繼鐵、鋁之后的第三金屬.
鈦(Ti)被稱為繼鐵、鋁之后的第三金屬.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電池工作時,鋅失去電子,電解液內部OH-向負極移動 | |
| B. | 電池正極的電極反應式為:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 電池工作時,電子由正極通過外電路流向負極 | |
| D. | 外電路中每通過0.2mol電子,鋅的質量理論上減小6.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨工業溫度選擇為700K左右,只要是為了提高NH3產率 | |
| B. | 使用催化劑和施加高壓,都能提高反應速率,但對化學平衡狀態無影響 | |
| C. | 合成氨生產過程中將NH3液化分離,可提高N2、H2的轉化率 | |
| D. | 合成氨工業中為了提高氫氣的利用率,可適當增加氫氣濃度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com