
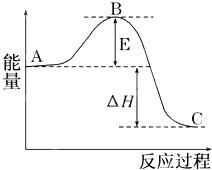
 2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ/mol.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 9 |
| 2 |
| 1 |
| 2 |
| 9 |
| 2 |


科目:高中化學 來源: 題型:
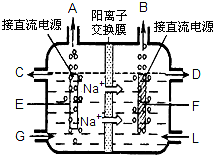 食鹽是日常生活必需品,也是重要的化工原料.
食鹽是日常生活必需品,也是重要的化工原料.| 加入試劑 |
| 過濾 |
| 適量鹽酸 |
| 蒸發、結晶、烘干 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 濃度/mol?L-1 時間/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 天然氣的主要成分甲烷燃燒生成二氧化碳和液態水的熱化學方程式是:
天然氣的主要成分甲烷燃燒生成二氧化碳和液態水的熱化學方程式是:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 和一個-Cl,它的可能結構分別是
和一個-Cl,它的可能結構分別是查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com