

| A. | 550℃時,若充入惰性氣體,v正,v退均減小,平衡不移動 | |
| B. | 650℃時,反應達平衡后CO2的轉化率為25.0% | |
| C. | T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動 | |
| D. | 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=24.0P總 |
分析 A、可變的恒壓密閉容器中反應,550℃時若充入惰性氣體,相當于減小壓強,則v正,v逆均減小,又該反應是氣體體積增大的反應,則平衡正向移動;
B、由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,根據三段式進行計算;
C、由圖可知,T℃時,反應達平衡后CO和CO2的體積分數都為50%即為平衡狀態;
D、925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=$\frac{P(CO){\;}^{2}}{P(C{O}_{2})}$,據此計算;
解答 解:A、可變的恒壓密閉容器中反應,550℃時若充入惰性氣體,相當于減小壓強,則v正,v逆均減小,又該反應是氣體體積增大的反應,則平衡正向移動,故A錯誤;
B、由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,轉化了xmol,
則有C(s)+CO2(g)?2CO(g)
開始 1 0
轉化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,則CO2的轉化率為$\frac{0.25}{1}$×100%=25%,故B正確;
C、由圖可知,T℃時,反應達平衡后CO和CO2的體積分數都為50%即為平衡狀態,所以平衡不移動,故C錯誤;
D、925℃時,CO的體積分數為96%,則CO2的體積分數都為4%,所以用平衡分壓代替平衡濃度表示的化學平衡常數Kp=$\frac{P(CO){\;}^{2}}{P(C{O}_{2})}$=$\frac{(0.96P)^{2}}{0.04P}$=23.0P,故D錯誤;
故選:B.
點評 本題考查了化學平衡圖象、閱讀題目獲取信息的能力等,難度中等,需要學生具備運用信息與基礎知識分析問題、解決問題的能力.


科目:高中化學 來源: 題型:解答題
 氯及其化合物在工業生產、生活中有重要的作用.請按要求回答下列問題.
氯及其化合物在工業生產、生活中有重要的作用.請按要求回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 30g HCHO與過量的新制的氫氧化銅懸濁液反應轉移了4NA個電子 | |
| B. | 1L 1mol/L 醋酸溶液中分子總數小于NA | |
| C. | 在1mol-CHO中所含電子數為15NA | |
| D. | 1mol CaHxNbOc的有機物中,H最多(2a+b+2)NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 纖維素、淀粉、脂肪、蛋白質都是高分子化合物 | |
| B. | 淀粉水解的最終產物都能發生銀鏡反應 | |
| C. | 誤食重金屬鹽而引起的中毒可服用大量豆漿或牛奶進行解救 | |
| D. | 脂肪能發生皂化反應,生成甘油和高級脂肪酸鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
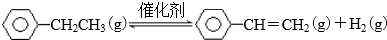
| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 點燃爆竹后,硫燃燒生成SO3 | |
| B. | 中國古代利用明礬溶液的酸性清除銅鏡表面的銅銹 | |
| C. | 服用阿司匹林出現水楊酸反應時,用NaHCO3溶液解毒 | |
| D. | 使用含鈣離子濃度較大的地下水洗衣服,肥皂去污能力減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | △H1=△H2+△H3 | |
| C. | Cl、Br、I的非金屬性依次減弱,所以途徑Ⅱ吸收的熱量按Cl、Br、I的順序依次增多 | |
| D. | 途徑Ⅰ生成HCl放出的熱量比生成HBr的多,說明HCl比HBr穩定 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com