
 氯及其化合物在工業生產、生活中有重要的作用.請按要求回答下列問題.
氯及其化合物在工業生產、生活中有重要的作用.請按要求回答下列問題.分析 (1)20mL 0.50mol/L鹽酸和20mL 0.55mol/L NaOH溶液中和反應,鹽酸的物質的量為0.01mol,反應生成0.01mol水,其反應熱△H=-a kJ/mol(a>0),則生成2mol水放出的熱量為200akJ;
(2)酸性條件下,氯離子與次氯酸根離子反應生成氯氣;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸鈣消耗氫離子,平衡正移;
(4)Fe與次氯酸根離子形成原電池時,次氯酸根離子在正極上得電子;
(5)①NaClO的質量分數越高,反應所用時間越短;
②設溶液的體積為1L,則在2d時次氯酸鈉的質量為1000×6.500%=65.00g,4d時次氯酸鈉的質量為1000×5.755%=57.55g,其質量變化為7.45g,再求出物質的量變化及反應速率;
③電解冷飽和食鹽水,在陰極上氫離子得電子生成氫氣,氯離子在陽極失電子生成次氯酸根離子.
解答 解:(1)20mL 0.50mol/L鹽酸和20mL 0.55mol/L NaOH溶液中和反應,鹽酸的物質的量為0.01mol,反應生成0.01mol水,其反應熱△H=-a kJ/mol(a>0),則生成2mol水放出的熱量為200akJ,則稀硫酸與氫氧化鈉的熱化學方程式為H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
故答案為:H2SO4(aq)+2NaOH(aq)=Na2SO4 (aq)+2H2O (l)△H=-200a kJ/mol;
(2)酸性條件下,氯離子與次氯酸根離子反應生成氯氣,氯氣屬于有毒氣體,其反應的離子方程為:Cl-+ClO-+2H+=Cl2↑+H2O;
故答案為:Cl-+ClO-+2H+=Cl2↑+H2O;
(3)氯水中存在Cl2+H2O?H++Cl-+HClO,加碳酸鈣消耗氫離子,生成二氧化碳,平衡正移,則反應的現象為氯水淺黃綠色逐漸褪去,同時產生少量氣體;由于Cl2+H2O?H++Cl-+HClO的平衡正向移動,使HClO濃度加大,故漂白速率增大,漂白效果增強,所以溶液中滴加幾滴石蕊試劑,發現試劑紫色迅速褪去;
故答案為:氯水淺黃綠色逐漸褪去,同時產生少量氣體;大理石消耗了氯水中的H+,而使Cl2+H2O?H++Cl-+HClO的平衡向正向移動,使HClO濃度加大,故漂白速率增大,漂白效果增強;
(4)Fe與次氯酸根離子形成原電池時,次氯酸根離子在正極上得電子,則正極的電極反應式為:ClO-+2e-+H2O=Cl-+2OH-;
故答案為:ClO-+2e-+H2O=Cl-+2OH-;
(5)①由圖可知,NaClO的質量分數越高,反應所用時間越短,反應速率越快;
故答案為:相同條件下,NaClO的質量分數越高,分解速率越快;
②設溶液的體積為1L,溶液的密度為1g/cm3,則在2d時次氯酸鈉的質量為1000×6.500%=65.00g,4d時次氯酸鈉的質量為1000×5.755%=57.55g,
其質量變化為7.45g,
則△n=$\frac{m}{M}$=$\frac{7.45g}{74.5g/mol}$=0.1mol,v=$\frac{\frac{0.1mol}{1L}}{2d}$=0.05mol/(L•d);
故答案為:0.05;
③電解冷飽和食鹽水,在陰極上氫離子得電子生成氫氣,氯離子在陽極失電子生成次氯酸根離子,則電解反應的離子方程式:Cl-+H2O$\frac{\underline{\;電解\;}}{\;}$ClO-+H2↑;
故答案為:Cl-+H2O$\frac{\underline{\;電解\;}}{\;}$ClO-+H2↑.
點評 本題考查了熱化學方程式、有關方程式的計算、原電池原理和電解池原理的應用、反應速率的計算等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 ,Cl的基態原子外圍電子層排布式為3s23p5;
,Cl的基態原子外圍電子層排布式為3s23p5;| 第一電離能 | 鍵能 | 沸點 |
| O>Na | H-Cl>H-Si | CO2<H2O |
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該有機物不同化學環境的氫原子有4種 | |
| B. | 該有機物屬于芳香族化合物 | |
| C. | 鍵線式中的Et代表的基團為-CH3 | |
| D. | 該有機物在一定條件下能夠發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | X、R的最高化合價相同 | |
| B. | 簡單離子的半徑:Y>Z>X | |
| C. | Y、Z、R對應的最高價氧化物的水化物相互之間可以發生反應 | |
| D. | 電解熔融的X與Z構成的化合物可以得到單質Z |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SOCl2是氧化劑,Li是還原劑 | |
| B. | 2 mol SOCl2參加反應,共轉移4 mol電子 | |
| C. | 若將該反應設計成原電池,SOCl2在正極發生反應 | |
| D. | 若將該反應設計成原電池,可用稀硫酸作電解質溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
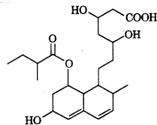 普伐他汀是一種調節血脂的藥物,其結構簡式如圖所示.下列關于普伐他汀的描述錯誤的是( )
普伐他汀是一種調節血脂的藥物,其結構簡式如圖所示.下列關于普伐他汀的描述錯誤的是( )| A. | 分子中含有四種官能團 | |
| B. | 1 mol該物質最多可與3 mol NaOH反應 | |
| C. | 能發生加成反應、取代反應、水解反應 | |
| D. | 1 mol該物質最多可與2 mol H2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 550℃時,若充入惰性氣體,v正,v退均減小,平衡不移動 | |
| B. | 650℃時,反應達平衡后CO2的轉化率為25.0% | |
| C. | T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動 | |
| D. | 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=24.0P總 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com