
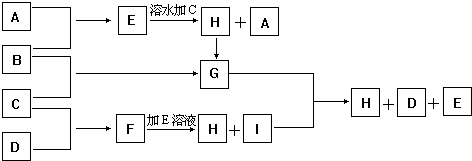
分析 常溫時A為淡黃色固體單質,則A為S,G溶于水得黃棕色溶液,則G中含鐵離子,由元素守恒可知C為Fe,C與D反應生成F不溶水,則F為FeS,氣體單質B與Fe反應生成G,則B具有強氧化性,故B為Cl2,G為FeCl3,氣體單質B與氯氣反應生成E,而E為氣體且極易溶水成為無色溶液,E溶液與Fe反應生成H與A,H轉化得到G,則A為H2,E為HCl,H為FeCl2,由F與鹽酸反應可知I為H2S,硫化氫與氯化鐵反應得到S、氯化亞鐵、HCl,據此解答.
解答 解:常溫時A為淡黃色固體單質,則A為S,G溶于水得黃棕色溶液,則G中含鐵離子,由元素守恒可知C為Fe,C與D反應生成F不溶水,則F為FeS,氣體單質B與Fe反應生成G,則B具有強氧化性,故B為Cl2,G為FeCl3,氣體單質B與氯氣反應生成E,而E為氣體且極易溶水成為無色溶液,E溶液與Fe反應生成H與A,H轉化得到G,則A為H2,E為HCl,H為FeCl2,由F與鹽酸反應可知I為H2S,硫化氫與氯化鐵反應得到S、氯化亞鐵、HCl.
(1)由上述分析可知,A為H2,B為Cl2,C為Fe,D為S,故答案為:H2;Cl2;Fe;S;
(2)H+B→G的離子方程式:2Fe2++Cl2=2Fe3++2Cl-,故答案為:2Fe2++Cl2=2Fe3++2Cl-;
(3)G+I→H+D+E的化學方程式:2FeCl3+H2S═2FeCl2+S↓+2HCl,故答案為:2FeCl3+H2S═2FeCl2+S↓+2HCl;
(4)①制漂白粉的化學方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②漂白粉溶液中加入過量的KI溶液和過量的硫酸,發生反應離子方程式為:2H++2I-+ClO-=I2+Cl-+H2O,由2Na2S2O3+I2=Na2S4O6+2NaI,可得關系式:Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=$\frac{1}{4}$n(Na2S2O3)=$\frac{1}{4}$×0.02 L×0.2 mol•L-1×$\frac{250mL}{25mL}$=0.01 mol,
Ca(ClO)2%=$\frac{0.01mol×143g/mol}{3g}$×100%=47.67%,
故答案為:2H++2I-+ClO-=I2+Cl-+H2O;47.67%.
點評 本題考查無機物推斷,涉及Fe、Cl元素化合物性質,物質的顏色及性質是推斷突破口,再結合轉化關系推斷,需要學生熟練掌握元素化合物知識,(4)中計算為解答的難點,注意利用關系式法簡化計算過程,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,50g SO2和CO2的混合氣體中可能含有2NA個氧原子 | |
| B. | I mol Cl2與足量的鐵反應,轉移的電子數為3NA | |
| C. | 1 L0.1 mol•L-1氨水含有0.l NA個OH- | |
| D. | I mol乙醇中含有C-H鍵的數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自來水廠用含鐵的化合物作凈水劑 | |
| B. | 用丁達爾效應區分氫氧化鐵膠體和氯化鐵溶液 | |
| C. | 一束平行光照射蛋白質溶液時,從側面要看到光亮的通路 | |
| D. | 在三氯化鐵溶液中滴入氫氧化鈉溶液出現紅褐色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為17、中子數為20的氯(Cl)原子:${\;}_{17}^{20}$Cl | |
| B. | CO2電子式: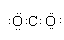 | |
| C. | 鎂離子的結構示意圖: | |
| D. | CCl4分子的比例模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電路中共轉移0.7mol電子 | |
| B. | 陰極得到的氣體物質的量為0.35mol | |
| C. | 陰極質量增加3.2g | |
| D. | 鋁元素以A1(OH)3的形式存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含碳原子數比為1:1 | B. | 體積比為1:1 | ||
| C. | 密度比為7:11 | D. | 分子數比為7:11 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com