
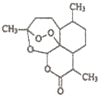
 中國藥學家屠呦呦因最早發現并提純抗瘧新藥青蒿素而獲得2015年度諾貝爾生理學或醫學獎.已知青蒿素可從與青蒿同屬的黃花蒿中提取,其結構如圖所示,下列有關青蒿素說法不正確的是( )
中國藥學家屠呦呦因最早發現并提純抗瘧新藥青蒿素而獲得2015年度諾貝爾生理學或醫學獎.已知青蒿素可從與青蒿同屬的黃花蒿中提取,其結構如圖所示,下列有關青蒿素說法不正確的是( )| A. | 化學式為C15H20O5 | |
| B. | 能與NaOH溶液發生反應 | |
| C. | 與H2O2含有相似結構,具有殺菌作用 | |
| D. | 提取方法主要是低溫萃取 |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
 $?_{高溫}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高溫}^{FeSO_{4}/Al_{2}O_{3}}$ +3H2(g)
+3H2(g)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 與Fe反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水電離的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含有-OH的有機化合物性質相同 | |
| B. | 鍋爐水垢中的CaSO4可用飽和Na2CO3溶液處理,使之轉化為CaCO3后再用鹽酸除去 | |
| C. | 鈉的金屬性比鉀強,工業上用鈉制取鉀(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有單質參加,又有單質生成的反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中;c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3mol•L-1 | |
| B. | 常溫下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| C. | NH4HSO3溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 等濃度、等體積的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
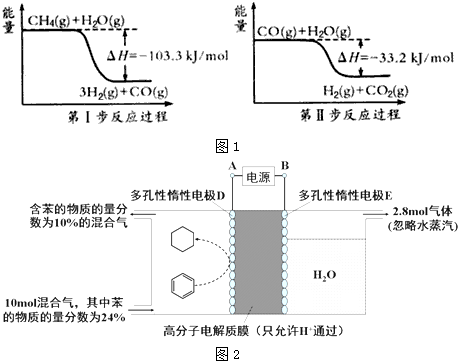
 太陽能的開發利用在新能源研究中占據重要地位,單晶硅太陽能電池片在加工時,一般摻雜微量的銅、锎、硼、鎵、硒等.回答下列問題:
太陽能的開發利用在新能源研究中占據重要地位,單晶硅太陽能電池片在加工時,一般摻雜微量的銅、锎、硼、鎵、硒等.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
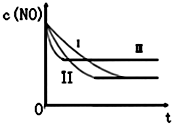 汽車尾氣中的主要污染物是NO和CO.為減輕大氣污染,人們提出通過以下反應來處理汽車尾氣:
汽車尾氣中的主要污染物是NO和CO.為減輕大氣污染,人們提出通過以下反應來處理汽車尾氣:| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 實驗 編號 | T/°C | NO初始濃 度/10-3mol•L-1 | CO初始濃 度/10-3mol•L-1 | 催化劑的比 表面積/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所 需時間/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂燃燒發出耀眼的白光,可用來制造信號彈和焰火 | |
| B. | 碳酸氫鈉能與酸反應,可用來治療胃酸過多 | |
| C. | 利用銅與氯化鐵溶液的反應來制作印刷電路板 | |
| D. | 鋁制品表面有致密的氧化膜保護層,可長時間盛放咸菜等腌制食品 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某課外活動小組同學用如圖裝置進行實驗,一段時間后在C電極表面有銅析出,試回答下列問題.
某課外活動小組同學用如圖裝置進行實驗,一段時間后在C電極表面有銅析出,試回答下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com