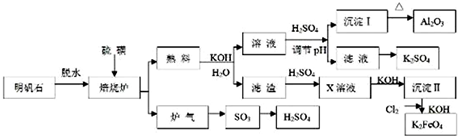
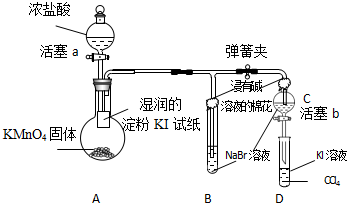
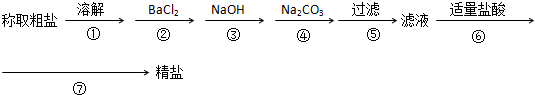
隨著能源與環境問題越來越被人們關注,碳一化學(C1化學)成為研究的熱點.“碳一化學”即以單質碳及CO、CO
2、CH
4、CH
3OH等含一個碳原子的物質為原料合成工業產品的化學與工藝.
(1)將CO
2轉化成有機物可有效實現碳循環.CO
2轉化成有機物的例子很多,如:
a.6CO
2+6H
2O
C
6H
12O
6b.CO
2=3H
2CH
3OH+H
2O
c.CO
2+CH
4CH
3COOHd.2CO
2+6H
2CH
2=CH
2+4H
2在以上屬于人工轉化的反應中,原子利用率最高的是
(填序號).
(2)CO可用于合成甲醇.在壓強0.1MPa條件下,在體積為bL的密閉容器中充入amolCO和2amolH
2,在催化劑作用下合成甲醇:CO(g)+2H
2(g)?CH
3OH(g).平衡時CO的轉化率與溫度、壓強的關系如圖.
①該反應屬于
反應(填“吸熱”或“放熱”).若一個可逆反應的平衡常數K值很大,對此反應的說法正確的是
(填序號).
a.反應使用催化劑意義不大
b.該反應發生將在很短時間內完成
c.該反應達到平衡時至少有一種反應物百分含量很小
d.該反應一定是放熱反應
②100℃時,該反應的平衡常數K=
(用a,b的代數式表示).
(3)二甲醚(CH
3OCH
3)被稱為21世紀的新型燃料,也可替代氟利昂作制冷劑等,對臭氧層無破壞作用.工業上可利用煤的氣化產物(水煤氣)合成二甲醚.
①工業上利用水煤氣合成二甲醚的三步反應如下:
a.2H
2(g)+CO(g)?CH
3OH(g)△H
1=-90.8kJ.mol
-1b.2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ.mol
-c.CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41.3kJ.mol
總反應:3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)的△H=
.
②對于反應b,在溫度和容積不變的條件下,能說明該反應已達到平衡狀態的是
(填字母).
a.n(CH
3OH)=n(CH
3OCH
3)=n(H
2O)
b.容器內壓強保持不變
c.H
2O(g)的濃度保持不變
d.CH
3OH的消耗速率與CH
3OCH
3的消耗速率之比為2:1
(4)以KOH溶液為電解質,用二甲醚-空氣組成燃料,其中負極的電極反應式為
.
(5)C1化合物在治理汽車尾氣方面也大有可為,如CO、CH
4等在一定條件下均可以與氮氧化物生成無污染的物質.寫出CO與氮氧化物(NO
x)在有催化劑的條件下反應的化學方程式
.

 隨著能源與環境問題越來越被人們關注,碳一化學(C1化學)成為研究的熱點.“碳一化學”即以單質碳及CO、CO2、CH4、CH3OH等含一個碳原子的物質為原料合成工業產品的化學與工藝.
隨著能源與環境問題越來越被人們關注,碳一化學(C1化學)成為研究的熱點.“碳一化學”即以單質碳及CO、CO2、CH4、CH3OH等含一個碳原子的物質為原料合成工業產品的化學與工藝.