
| A. | (m-0.1)g | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
分析 金屬氧化物與硫酸反應生成硫酸鹽和水,由反應CuO~CuSO4,FeO~FeSO4,Fe2O3~Fe2(SO4)3,可知H2SO4的物質的量等于金屬氧化物中O元素的物質的量,據此計算金屬氧化物中氧元素的質量,金屬氧化物的質量減去氧的質量即為金屬的質量.
解答 解:由反應CuO~CuSO4,FeO~FeSO4,Fe2O3~Fe2(SO4)3,可知H2SO4的物質的量等于金屬氧化物中O元素的物質的量,n(H2SO4)=0.1L×1mol/L=0.1mol,
所以金屬氧化物中O的質量為:0.1mol×16g/mol=1.6g,
若將mg原混合物在足量氫氣中加熱,使其充分反應,冷卻后剩余固體為金屬單質,
則金屬質量為氧化物的質量減去氧的質量,
所以冷卻后剩余金屬質量=mg-1.6g=(m-1.6)g,
故選D.
點評 本題考查混合物反應的計算,題目難度中等,注意根據反應的特點,確定金屬氧化物與硫酸反應的關系式,從而得出硫酸的物質的量與金屬氧化物中O氧原子物質的量相等,是解答該題的關鍵,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 溫度/K | 起始物質的量/mol | 平衡物質的量/mol | 平衡常數 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 該反應正反應為吸熱反應 | |
| B. | 607K時,把物質的量均為0.1mol四種反應物加入該反應器中,反應將向正反應方向進行 | |
| C. | 實驗Ⅱ達到平衡時容器中COS的物質的量為0.02mol | |
| D. | 實驗Ⅲ中,無論是開始還是至化學平衡狀態,混合氣體的密度始終不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
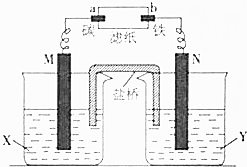 根據反應:Zn+CuSO4═Cu+ZnSO4設計原電池進行如圖所示實驗,濾紙上滴有酚酞和氯化鈉溶液.實驗進行一段時間后,在b電極附近出現紅色.請回答下列問題:
根據反應:Zn+CuSO4═Cu+ZnSO4設計原電池進行如圖所示實驗,濾紙上滴有酚酞和氯化鈉溶液.實驗進行一段時間后,在b電極附近出現紅色.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
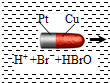 一種子彈頭形的納米銅鉑電池,它在稀溴水中能沿著銅極方向移動(如圖),電池反應為:Cu+Br2=CuBr2.下列說法正確的是( )
一種子彈頭形的納米銅鉑電池,它在稀溴水中能沿著銅極方向移動(如圖),電池反應為:Cu+Br2=CuBr2.下列說法正確的是( )| A. | 銅為電池的正極 | |
| B. | 鉑不斷溶解 | |
| C. | 稀溴水為電解質溶液 | |
| D. | 電池工作時實現機械能向電能再向化學能轉化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O2是淡黃色固體,久置于空氣中變成Na2O | |
| B. | Na2O2與水的反應中,Na2O2只作氧化劑 | |
| C. | 用Na2O2漂白過的織物、麥桿等日久又漸漸變成黃色 | |
| D. | Na2O2放入飽和NaOH溶液中,放出大量的O2,并有白色固體析出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 大于10.00mL | B. | 小于10.00mL | C. | 等于10.00mL | D. | 等于11.00mL |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com