
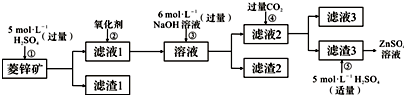
分析 I.由圖或者流程可知,菱鋅礦的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反應,經過過濾進行分離,則濾渣1為SiO2,濾液1含有硫酸銅、硫酸亞鐵、硫酸鋅、剩余的硫酸,②加氧化劑將亞鐵離子氧化為鐵離子,再加過量的NaOH,Zn2+轉化ZnO22-,使Cu2+、Fe3+轉化為沉淀,通過過濾從溶液中除去,則濾渣2為Fe(OH)3、Cu(OH)2,濾液2中含有Na2ZnO2及過量的NaOH,④通二氧化碳將ZnO22-轉化為沉淀,則濾渣3為Zn(OH)2,步驟⑤主要發生氫氧化鋅與硫酸的反應,濾液3含有碳酸氫鈉.
(1)加氧化劑將亞鐵離子氧化為鐵離子,不能引入新雜質;
(2)上述各步驟中,只有步驟①中有二氧化碳生成;
(3)步驟④通二氧化碳將ZnO22-轉化為Zn(OH)2;
(4)Zn與NaOH溶液反應,Zn作負極,發生氧化反應失去電子,堿性條件下生成ZnO22-與H2O;
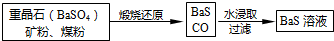
Ⅱ.(5)煅燒發生反應:BaSO4+C$\frac{\underline{\;高溫\;}}{\;}$BaS+4CO↑,根據已知熱化學方程式乘以適當的系數進行加減構造目標熱化學方程式;
Ⅲ.(6)步驟⑤中硫酸過量,過量的酸與BaS溶液混合會發生反應,產生有毒的H2S污染空氣,而且會降低鋅鋇白的產率.
解答 解:I.由圖或者流程可知,菱鋅礦的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等,加硫酸,只有SiO2不反應,經過過濾進行分離,則濾渣1為SiO2,濾液1含有硫酸銅、硫酸亞鐵、硫酸鋅、剩余的硫酸,②加氧化劑將亞鐵離子氧化為鐵離子,再加過量的NaOH,Zn2+轉化ZnO22-,使Cu2+、Fe3+轉化為沉淀,通過過濾從溶液中除去,則濾渣2為Fe(OH)3、Cu(OH)2,濾液2中含有Na2ZnO2及過量的NaOH,④通二氧化碳將ZnO22-轉化為沉淀,則濾渣3為Zn(OH)2,步驟⑤主要發生氫氧化鋅與硫酸的反應,濾液3含有碳酸氫鈉.
(1)加氧化劑將亞鐵離子氧化為鐵離子,不能引入新雜質,氯氣做氧化劑會引入氯離子,且氯氣有毒,濃HNO3做氧化劑會被還原為有毒氣體,引入雜質離子NO3-,KMnO4 做氧化劑會引入K+、MnO4-,過氧化氫做氧化劑被還原為水,不引入新的雜質,過量的過氧化氫加熱分解生成氧氣和水,
故選:D;
(2)上述各步驟中,只有步驟①中有二氧化碳生成,故選:①;
(3)步驟④通二氧化碳將ZnO22-轉化為Zn(OH)2,則濾渣3為Zn(OH)2,故答案為:Zn(OH)2;
(4)Zn與NaOH溶液反應,Zn作負極,發生氧化反應失去電子,堿性條件下生成ZnO22-與H2O,負極電極反應式為:Zn-2e-+4OH-=ZnO22-+2H2O,故答案為:Zn-2e-+4OH-=ZnO22-+2H2O;
Ⅱ.(5)煅燒發生反應:BaSO4+C$\frac{\underline{\;高溫\;}}{\;}$BaS+4CO↑,
已知:①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1
依據蓋斯定律,②×4-③-①得到熱化學方程式為:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案為:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
Ⅲ.(6)步驟⑤中硫酸過量,過量的酸與BaS溶液混合會發生反應,產生有毒的H2S污染空氣,而且會降低鋅鋇白的產率,
故答案為:過量的酸與BaS溶液混合會產生有毒的H2S污染空氣,而且會降低鋅鋇白的產率.
點評 本題考查物質制備工藝流程,涉及物質的分離提純、對操作步驟及試劑的分析評價、電極反應式書寫、熱化學方程式書寫等,理解工藝流程原理是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 易液化,可用作制冷材料 | |
| B. | CO2晶體中,每個C原子周圍結合2個O原子,每個O原子跟1個C原子結合 | |
| C. | 硬度很大,可用作耐磨材料 | |
| D. | 在一定條件下,CO2分子晶體轉化為原子晶體是物理變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
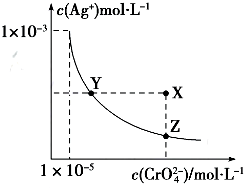
| A. | t℃時,Ag2CrO4的Ksp為1×10-12 | |
| B. | t℃時,向飽和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡時c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃時,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃時,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 轉移0.1mol電子時,a電極產生1.12LH2 | |
| B. | b電極上發生的電極反應是:2H2O+2e-=H2↑+2OH- | |
| C. | c電極上進行還原反應,B電池中的H+可以通過隔膜進入A池 | |
| D. | d電極上發生的電極反應是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加熱 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com