
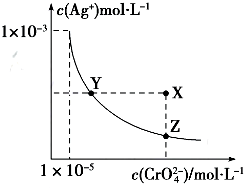
| A. | t℃時,Ag2CrO4的Ksp為1×10-12 | |
| B. | t℃時,向飽和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡時c2(Ag+)×c(CrO42-)>Ksp | |
| C. | t℃時,Ksp(AgCl)=1.56×10-10 | |
| D. | t℃時,用0.01mol•L-1 AgNO3溶液滴定20mL 0.01mol•L-1KCl和0.01mol K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
分析 A、依據圖象曲線上的數據結合溶度積常數概念計算得到;曲線上的點是沉淀溶解平衡,溶度積是飽和溶液中離子濃度冪次方的乘積;
B、溶度積常數只與溫度有關,溫度不變,溶度積常數不變;
C、依據Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)的K=2.5×107,計算得出Ksp(AgCl);
D、依據溶液中離子濃度結合溶度積常數計算銀離子濃度,銀離子濃度越小先析出沉淀.
解答 解:A、依據圖象曲線上的數據結合溶度積常數概念計算得到;曲線上的點是沉淀溶解平衡,Ag2CrO4的沉淀溶劑平衡為:Ag2CrO4(s)?2Ag+CrO42-,
Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A正確;
B、溶度積常數只與溫度有關,溫度不變,溶度積常數不變,故B錯誤;
C、Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)的K=$\frac{c(Cr{{O}_{4}}^{2-})}{{c}^{2}(C{l}^{-})}=\frac{c(A{g}^{+})^{2}•c(Cr{{O}_{4}}^{2-})}{{c}^{2}(A{g}^{+})×c(C{l}^{-})}$=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{Ks{p}^{2}(AgCl)}$=$\frac{1×1{0}^{-12}}{Ks{p}^{2}(AgCl)}$=2.5×107,解Ksp(AgCl)=$\sqrt{\frac{1×1{0}^{-12}}{2.5×1{0}^{7}}}$=2×10-10,故C錯誤;
D、依據溶度積常數計算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)×c(Cl-)=2×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=$\sqrt{\frac{1{0}^{-12}}{1{0}^{-2}}}$=1×10-5mol/L;0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依據溶度積計算得到:c(Ag+)=$\frac{2×1{0}^{-10}}{1{0}^{-2}}$=2×10-8mol/L;所以先析出氯化銀沉淀,故D錯誤,故選A.
點評 本題考查了沉淀溶解平衡的分析判斷,溶度積常數的計算應用,溶度積是隨溫度變化,題目難度中等.


科目:高中化學 來源: 題型:填空題
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
 .
. ,該氫化物的水溶液顯堿性(填“酸性”、“堿性”或“中性”),該溶液與少量AlCl3溶液反應的離子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,該氫化物的水溶液顯堿性(填“酸性”、“堿性”或“中性”),該溶液與少量AlCl3溶液反應的離子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 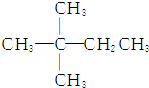 | B. | CH3CH2CH2CH2CH3 | ||
| C. | 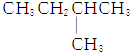 | D. | 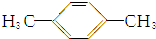 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 穩定性:HBr>HCl>HF | ||
| C. | 原子半徑:r(Si)>r(N)>r(O) | D. | 堿性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
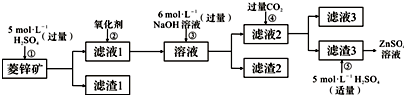
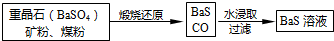
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
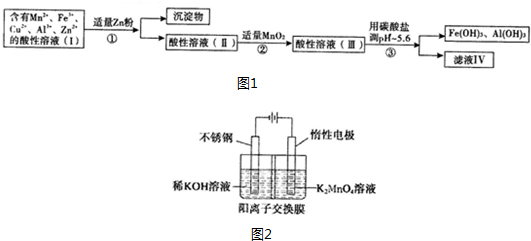
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com