
分析 (1)經過CaO吸收后,體積減少2.8L,n(C)=n(CO2)=$\frac{2.8L}{22.4L/mol}$=0.125mol;
剩余氧氣:n(O2)=5.00L-0.56L-2.80L=1.64L,則反應氧氣為:5L-1.64L=3.36L,物質的量為:$\frac{3.36L}{22.4L/mol}$=0.15mol,
由質量守恒可得m(H2O)=3.40 g+0.15mol×32 g•mol-0.125 mol×44 g•mol-1=2.7 g
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.3mol,再根據總質量計算出氧元素的質量及物質的量,再計算出該醇中C、H、O的原子個數之比;
(2)根據計算出的該醇中C、H、O的原子個數之比判斷能否確定該醇的分子式;
(3)將該多元醇的任意一個羥基換成一個鹵原子,所得到的鹵代物都只有一種,說明分子中-OH的化學環境都相同,結合有機物分子式確定其結構簡式.
解答 解:(1)經過CaO吸收后,體積減少2.8L,n(C)=n(CO2)=$\frac{2.8L}{22.4L/mol}$=0.125mol;
剩余氧氣:n(O2)=5.00L-0.56L-2.80L=1.64L,則反應氧氣為:5L-1.64L=3.36L,物質的量為:$\frac{3.36L}{22.4L/mol}$=0.15mol,
由質量守恒可得m(H2O)=3.40 g+0.15mol×32 g•mol-0.125 mol×44 g•mol-1=2.7 g
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.300mol,醇中含O:$\frac{3.40g-0.3mol×1g/mol-0.125mol×12g/mol}{16g/mol}$=0.100mol,
則該醇中C、H、O的原子數之比為N(C):N(H):N(O)=0.125:0.3:0.1=5:12:4;
故答案為:0.125;0.300;0.100;5:12:4;
(2)由于該有機物的最簡式C5H12O4中H原子個數已經飽和碳原子四價結構,所以能夠確定其分子式,即:其實驗式即為分子式,
故答案為:能;最簡式C5H12O4中H原子個數已經飽和碳原子四價結構,所以最簡式即分子式;
(3)將該多元醇的任意一個羥基換成一個鹵原子,所得到的鹵代物都只有一種,說明分子中-OH的化學環境都相同,其結構簡式為:C(CH2OH)4,
答:該飽和多元醇的結構簡式為C(CH2OH)4.
點評 本題考查了有機物分子式、結構簡式的確定的計算,題目難度中等,注意熟練掌握根據質量守恒確定有機物分子中C、H、O元素組成及數目的方法.注意最簡式中H原子個數已經飽和碳原子四價結構,則實驗式即為分子式.


科目:高中化學 來源: 題型:選擇題
| A. | 兩份質量相同的鎂分別與足量氮氣、二氧化碳反應,增重的質量相同 | |
| B. | 兩份質量相同的硫分別與足量氫氧化鈉和鈉反應,兩者轉移的電子數相同 | |
| C. | 相同物質的量CO2、H2O分別與足量Na2O2反應,生成氣體的體積相同 | |
| D. | 氫氣分別通過灼熱的CuO和Fe2O3粉末,當轉移電子數相同時,固體減輕的質量相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
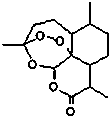 東晉醫藥學家葛洪的《肘后備急方•治寒熱諸瘧方》記載有“青蒿一握,以水二升漬,絞取汁,盡服之”的說法,說明不能加熱青蒿,因高溫可能使活性成分受損.中國藥學家屠呦呦用沸點只有35℃的乙醚作為溶劑來提取青蒿素,創制出新型抗瘧藥青蒿素和雙氫青蒿素,為此獲得2015年諾貝爾生理學或醫學獎.已知青蒿素的結構如圖所示,下列有關青蒿素的說法,不正確的是( )
東晉醫藥學家葛洪的《肘后備急方•治寒熱諸瘧方》記載有“青蒿一握,以水二升漬,絞取汁,盡服之”的說法,說明不能加熱青蒿,因高溫可能使活性成分受損.中國藥學家屠呦呦用沸點只有35℃的乙醚作為溶劑來提取青蒿素,創制出新型抗瘧藥青蒿素和雙氫青蒿素,為此獲得2015年諾貝爾生理學或醫學獎.已知青蒿素的結構如圖所示,下列有關青蒿素的說法,不正確的是( )| A. | 分子式為C15H22O5 | |
| B. | 能夠發生水解反應 | |
| C. | 用沸點只有35℃的乙醚作為溶劑來提取青蒿素的方法化學上叫萃取 | |
| D. | 青蒿素能夠治療瘧疾可能與結構中存在過氧鍵或酯基等基團有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1KHS溶液中c(HS-)+c(S2-)+c(H2S)=0.1mol•L-1 | |
| B. | 飽和食鹽水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | pH=11的NaOH溶液與pH=3的CH2COOH溶液等體積混合后c(CH2COO-)>c(Na+)>c(H+)>c(0H-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(OH-)=c(HCO3-)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
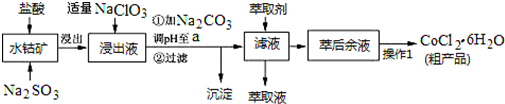
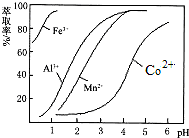
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 核外電子是分層運動的 | |
| B. | 所有電子在同一區域里運動 | |
| C. | 能量高的電子在離核近的區域運動 | |
| D. | 不同能量的電子在核外運動占有的區域形狀可能不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com