
分析 計算NaCl的物質的量,根據化學方程式計算生成氯氣、氫氧化鈉物質的量,再根據V=nVm計算氯氣體積,根據c=$\frac{n}{V}$計算NaOH的物質的量濃度.
解答 解:11.7g NaCl的物質的量為$\frac{11.7g}{58.5g/mol}$=0.2mol
2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑
2 2 1
0.2mol n(NaOH) n(Cl2)
所以n(Cl2)=$\frac{0.2mol×1}{2}$=0.1mol
n(NaOH)=$\frac{0.2mol×2}{2}$=0.2mol
則標況下生成氯氣體積為0.1mol×22.4L/mol=2.24L,
所得NaOH的物質的量濃度為$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:在標準狀況下制得Cl2為2.24L,所得NaOH的物質的量濃度為0.4mol/L.
點評 本題以氯堿工業為載體,考查化學方程式有關計算,比較基礎,旨在考查學生對基礎知識的理解掌握與應用.


 經典密卷系列答案
經典密卷系列答案 金牌課堂練系列答案
金牌課堂練系列答案 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 可以用堿石灰來干燥SO2氣體 | |
| B. | 通入BaCl2溶液中,能生成白色沉淀 | |
| C. | 因為SO2有漂白性,所以它能使品紅溶液、溴水褪色 | |
| D. | 將SO2氣體通入裝有品紅溶液的試管里,紅色逐漸褪去,給試管加熱恢復紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向漂粉精溶液中通入過量的二氧化碳:ClO-+H2O+CO2═HClO+HCO3- | |
| B. | 氯氣與水反應:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 二氧化錳與濃鹽酸反應:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+2Cl2↑, | |
| D. | 碳酸鈣粉末與新制氯水反應:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
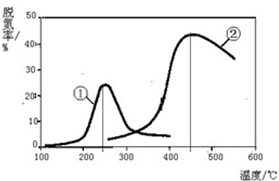 進入冬季北方開始供暖后,霧霾天氣愈發嚴重,各地PM2.5、PM10經常“爆表”.引發霧霾天氣的污染物中,最為常見的是機動車尾氣中的氮氧化物和燃煤產生的煙氣.
進入冬季北方開始供暖后,霧霾天氣愈發嚴重,各地PM2.5、PM10經常“爆表”.引發霧霾天氣的污染物中,最為常見的是機動車尾氣中的氮氧化物和燃煤產生的煙氣.時間/min 溫度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
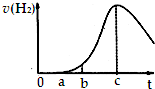 把在空氣中久置的鋁片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的燒杯中,該鋁片與硫酸反應產生氫氣的速率與反應時間可用如圖的坐標曲線來表示,則( )
把在空氣中久置的鋁片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的燒杯中,該鋁片與硫酸反應產生氫氣的速率與反應時間可用如圖的坐標曲線來表示,則( )| A. | 曲線由0→a段發生了氧化還原反應 | |
| B. | 曲線由b→c段,產生氫氣的速率增加較快的主要原因是反應放熱 | |
| C. | c點達到了平衡 | |
| D. | c點以后,反應逐漸消耗了產生的氫氣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com