
 進入冬季北方開始供暖后,霧霾天氣愈發嚴重,各地PM2.5、PM10經常“爆表”.引發霧霾天氣的污染物中,最為常見的是機動車尾氣中的氮氧化物和燃煤產生的煙氣.
進入冬季北方開始供暖后,霧霾天氣愈發嚴重,各地PM2.5、PM10經常“爆表”.引發霧霾天氣的污染物中,最為常見的是機動車尾氣中的氮氧化物和燃煤產生的煙氣.時間/min 溫度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
分析 Ⅰ.透光率不再發生改變,說明二氧化氮的濃度不變,反應到達平衡;
Ⅱ.(1)熵是用描述混亂程度的,△S就是混亂程度的變化,根據反應前后氣體體積變化判斷熵變;
(2)A、催化劑只影響反應速率,不會改變轉化率;
B、根據反應原理可知,正反應是體積增大的反應,壓強影響脫氮率;
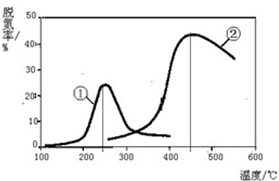
C、根據圖象數據可知,催化劑①、②發揮增大催化效果的溫度分別為250℃和450℃;
Ⅲ.(3)已知:CH4(g)的標準燃燒熱為-890kJ/mol,蒸發1mol H2O(l)需要吸收44kJ熱量.寫出熱化學方程式,結合蓋斯定律計算得到所需熱化學方程式;
(4)①根據v=$\frac{△c}{△t}$ 計算v(NO2),再利用速率之比等于化學計量數之比計算v(CH4);
②由表中數據可知,T2溫度反應速率較快,溫度越高,反應速率越快,先到達平衡,而升高溫度,NO2的物質的量增大,說明平衡逆向移動;
③化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;溫度為T1℃時,40min到達平衡,計算平衡時各組分濃度,代入平衡常數表達式計算;
④溫度為T2℃時,達平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,等效在原平衡基礎上增大壓強,平衡逆向移動.
解答 解:Ⅰ.透光率不再發生改變,說明二氧化氮的濃度不變,反應到達平衡,
a.氣體顏色不再改變,說明二氧化氮濃度不變,透光率不再發生改變,故a正確;
b.焓變△H與是否到達平衡無關,與物質的聚集狀態與化學計量數有關,故b錯誤;
c.應是2v正(N2O4)=v逆(NO2)時,反應到達平衡,二氧化氮的濃度不變,故c錯誤;
d.N2O4的轉化率不再改變,反應到達平衡,二氧化氮的濃度不變,透光率不再發生改變,故d正確,
故答案為:ad;
Ⅱ.(1)反應前氣體的化學計量數為4,反應后計量數之和為5,正反應是混亂度增加的反應,所以△S>0;故答案為:>;
(2)A.催化劑不會影響轉化率,只影響反應速率,所以第②種催化劑和第①種催化劑對轉化率沒有影響,故A錯誤;
B.該反應為體積增大的反應,增大壓強,平衡向著逆向移動,所以壓強對脫氮率有影響,故B錯誤;
C.由圖象可知,催化劑①、②分別適合于250℃和450℃左右脫氮,其催化活性最好,故C正確;
故答案為:C;
Ⅲ.(3)CH4(g)的標準燃燒熱為-890kJ/mol,熱化學方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol,
蒸發1mol H2O(l)需要吸收44kJ熱量,反應的熱化學方程式:②H2O(l)=H2O(g)△H=44KJ/mol,
③CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
④2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
依據蓋斯定律計算①+②×2+③-④×2CH4催化還原NO2(g)生成N2和H2O(g)的熱化學方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844kJ/mol,
故答案為:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844kJ/mol;
(4)①溫度為T1℃時,0~20min內v(NO2)=$\frac{\frac{1.2mol-0.7mol}{1L}}{20s}$=0.025mol/(L.s),速率之比等于化學計量數之比,則v(CH4)=$\frac{1}{2}$v(NO2)=0.0125mol/(L.s),
故答案為:0.0125mol/(L.s);
②由表中數據可知,T2溫度反應速率較快,溫度越高,反應速率越快,故溫度T1<T2,溫度T2先到達平衡,而升高溫度,NO2的物質的量增大,說明平衡逆向移動,故正反應為放熱反應,則△H<0,
故答案為:<;升高溫度,NO2的物質的量增大,平衡逆向移動,正反應為放熱反應;
③溫度為T1℃時,40min到達平衡,平衡時二氧化氮物質的量為0.4mol,則:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
起始量(mol):0.5 1.2 0 0 0
變化量(mol):0.4 0.8 0.4 0.4 0.8
平衡量(mol):0.1 0.4 0.4 0.4 0.8
容器的體積為1L,則平衡常數K=$\frac{c({N}_{2})×c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$=$\frac{0.4×0.4×0.{8}^{2}}{0.1×0.{4}^{2}}$=6.4,
故答案為:6.4;
④溫度為T2℃時,達平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,等效在原平衡基礎上增大壓強,平衡逆向移動,達新平衡時CH4的轉化率將減小,
故答案為:減小.
點評 本題考查化學平衡計算與影響因素、平衡常數、平衡狀態判斷等,側重考查學生分析計算能力,難度中等.


科目:高中化學 來源: 題型:選擇題
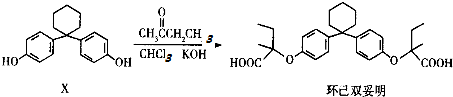
| A. | 有機物X的分子式為C18H22O2 | |
| B. | 有機物X與環己雙妥明互為同系物 | |
| C. | 環己雙妥明苯環上的一氯代物有4種 | |
| D. | 環己雙妥明能與碳酸氫鈉溶液發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 分別加熱Na2CO3和NaHCO3固體 | 試管內壁均有水珠 | 兩種物質均受熱分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈紅色 | 溶液中一定含有Fe2+ |
| C | 向含I-的無色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液變成藍色 | 氧化性:Cl2>I2 |
| D | 加熱盛有NH4Cl固體的試管 | 試管底部固體消失,試管口有晶體凝結. | NH4Cl固體可以升華 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁的質量為$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 與金屬反應后剩余鹽酸為(c1V1-2b)mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com