
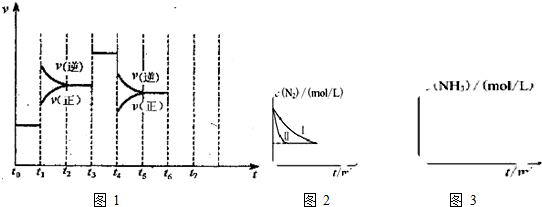
分析 (1)由圖可知,t1正逆反應速率均增大,且逆反應速率大于正反應速率;t3正逆反應速率同等程度的增大;t4時正逆反應速率均減小,且逆反應速率大于正反應速率;
(2)由圖可知,t1平衡逆向移動,t3不移動,t4平衡逆向移動,根據移動結果分析;
(3)t6時刻分離出部分NH3,v逆立刻減小,而v正逐漸減小,在t7時刻二者相等,反應重新達平衡,據此可畫出反應速率的變化曲線;
(4)合成氨反應為放熱反應,升高溫度平衡逆向移動,平衡時氨氣濃度減小,但反應速率變快,所以達到平衡的時間變短,據此可畫出圖象.
解答 解:(1)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,該反應為放熱反應,且為氣體體積減小的反應,則由圖可知,t1正逆反應速率均增大,且逆反應速率大于正反應速率,改變條件應為升高溫度;
t3正逆反應速率同等程度的增大,改變條件應為使用催化劑;
t4時正逆反應速率均減小,且逆反應速率大于正反應速率,改變條件應為減小壓強,
故答案為:升高溫度;加入催化劑;減小壓強(或增大容器體積);
(2)由圖可知,t1平衡逆向移動,t3不移動,t4平衡逆向移動,均使氨氣的含量減少,則t0~t1氨氣的含量最大,
故答案為:t0~t1;
(3)t6時刻分離出部分NH3,v逆立刻減小,而v正逐漸減小,在t7時刻二者相等,反應重新達平衡,據此可畫出反應速率的變化曲線為: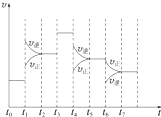 ,故答案為:
,故答案為: ;
;
(4)在實驗Ⅲ中改變條件為采用比實驗Ⅰ更高的溫度,由于升高溫度化學反應速率加快,達到平衡所需要的時間縮短,但是由于該反應是放熱反應,升高溫度,平衡向吸熱的逆反應方向移動,因此達到平衡時NH3的含量降低,用圖象表示實驗I和實驗Ⅲ中NH3濃度隨時間變化的示意圖是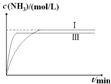 ,
,
故答案為: .
.
點評 本題考查影響化學反應速率的因素,注意把握反應的特點及圖象分析是解答的關鍵,明確溫度、壓強、催化劑對反應速率的影響即可解答,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 臭氧空洞 | B. | 酸雨 | C. | 光化學煙霧 | D. | 溫室效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
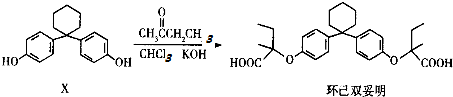
| A. | 有機物X的分子式為C18H22O2 | |
| B. | 有機物X與環己雙妥明互為同系物 | |
| C. | 環己雙妥明苯環上的一氯代物有4種 | |
| D. | 環己雙妥明能與碳酸氫鈉溶液發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 分別加熱Na2CO3和NaHCO3固體 | 試管內壁均有水珠 | 兩種物質均受熱分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈紅色 | 溶液中一定含有Fe2+ |
| C | 向含I-的無色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液變成藍色 | 氧化性:Cl2>I2 |
| D | 加熱盛有NH4Cl固體的試管 | 試管底部固體消失,試管口有晶體凝結. | NH4Cl固體可以升華 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
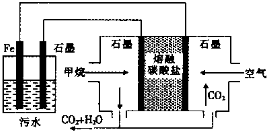
| A. | 左側裝置中的鐵電極可換成石墨電極 | |
| B. | 通入甲烷的石墨電極的電極反應式為:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空氣的石墨電極做正極,發生氧化反應 | |
| D. | 若左側裝置中石墨電極產生標準狀況下氣體44.8L氣體,則消耗2mol甲烷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com