

| 離子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 開始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |

分析 紅簾石主要成分有磁鐵礦(Fe3O4)、菱鐵礦(FeCO3)、錳礦(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等和稀硫酸反應,MnO2在酸性條件下被二價鐵還原為Mn2+,浸出液中的離子有:Fe2+、Fe3+、Mg2+、Mn2+、SO42-,濾渣A為SiO2,濾液中加入雙氧水,雙氧水氧化亞鐵離子生成鐵離子,再加入氨水生成氫氧化鐵沉淀,濾渣B為氫氧化鐵,加入氫氧化鉀、次氯酸鉀反應2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O生成K2FeO4,濾液為Mg2+、Mn2+、SO42-,電解生成金屬錳.
(1)增大接觸面積、提高溫度可以提高反應速率,所以粉碎紅簾石、提高反應的溫度可以提高稀硫酸浸取效率;
(2)紅簾石主要成分和稀硫酸反應,MnO2在酸性條件下被二價鐵還原為Mn2+,浸出液中的離子有:Fe2+、Fe3+、Mg2+、Mn2+、SO42-;
(3)二氧化錳中+4價的錳具有氧化性,亞鐵離子具有還原性,兩者發生氧化還原反應;
(4)過程②中加氨水調節溶液的pH等于6,完全沉淀時其pH<6的氫氧化物都能完全沉淀;
(5)電解陽極失去電子發生氧化反應,陰極得到電子發生還原反應,陽極以稀硫酸為電解液,陽極水電離出的氫氧根離子失去電子;
(6)次氯酸根離子具有氧化性,在堿性條件下氧化+3鐵生成+6價鐵,K2FeO4被譽為高效水處理劑的原因+6價鐵具有氧化性能殺菌,生成的+3價鐵水解生成氫氧化鐵膠體吸附懸浮物凈水.
解答 解:(1)增大接觸面積可提高反應的速率,溫度越高,反應速率越快,所以工業上為提高稀硫酸浸取效率一般采取的措施有:提高反應溫度、采用粉碎紅簾石可增大接觸面積等,
故答案為:①粉碎紅簾石;②提高反應的溫度;
(2)紅簾石主要成分有磁鐵礦(Fe3O4)、菱鐵礦(FeCO3)、錳礦(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等,加入硫酸:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O、FeCO3+H2SO4=FeSO4+CO2↑+H2O,MnCO3+H2SO4=MnSO4+CO2↑+H2O,2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,濾渣A為SiO2,浸出液中的陽離子有H+、Fe2+、Fe3+、Mg2+、Mn2+,
故答案為:H+、Fe2+、Fe3+、Mg2+、Mn2+;
(3)濾渣A中無MnO2原因MnO2在酸性條件下被二價鐵還原為Mn2+,反應為:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,
故答案為:MnO2在酸性條件下被二價鐵還原為Mn2+;
(4)過程②中加氨水調節溶液的pH等于6,完全沉淀時其pH<6的氫氧化物都能完全沉淀,根據表中數據知,Fe(OH)3,完全沉淀時需要的pH=3.7<6,所以濾渣的成分是Fe(OH)3,
故答案為:Fe(OH)3;
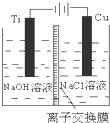
(5)圖示電解時原電池電子流向為A→B,則A為原電池的負極,A連接的電極為電解池的陰極,電解時陰離子移向陽極,則溶液中陰離子移動的方向為A→B,實際生產中,陽極以稀硫酸為電解液,陽極發生氧化反應,反應為:2H2O-4e-=O2↑+4H+,
故答案為:A→B;2H2O-4e-=O2↑+4H+;
(6)次氯酸根離子具有氧化性,在堿性條件下氧化+3鐵,反應為:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,K2FeO4被譽為高效水處理劑的原因+6價鐵具有氧化性能殺菌,生成的+3價鐵水解Fe3+可水解水解的方程式為Fe3++3H2O?Fe(OH)3(膠體)+3H+,生成具有吸附性的Fe(OH)3膠體,吸附雜質生成沉淀,
故答案為:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;FeO42-具有強氧化性可以殺菌消毒,還原成Fe3+水解成Fe(OH)3膠體能吸附雜質生成沉淀.
點評 本題考查了提取金屬錳并制得高效水處理劑(K2FeO4)工藝流程,側重考查物質分離和提純方法的綜合應用,要從整體上分析各個步驟發生的反應、反應原理等知識點,題目難度中等.


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加水稀釋,溶液中所有離子的濃度都減小 | |
| B. | 溶液中n(CH3COO-)+n(CH3COOH)=0.1mol | |
| C. | 升高溫度,醋酸的電離度增大 | |
| D. | 中和1L等物質的量濃度的NaOH溶液所消耗的醋酸體積大于1L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 裝置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等氣體 | |
| B. | 實驗②放置一段時間后,小試管內有晶體析出 | |
| C. | 實驗③振蕩后靜置,上層溶液顏色變淺 | |
| D. | 實驗④可用于分離飽和Na2CO3溶液和CH3COOC2H5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的三種方法:
納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的三種方法:| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法:2Cu+H2O $\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl-)大量減少 | |
| B. | ①的濾液中不含有Ag+ | |
| C. | ②的現象說明該溫度下Ag2S比Ag2SO4更難溶 | |
| D. | ③中生成Ag(NH3)2+,使c(Ag+)減小,促進AgCl(s)溶解平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com