
 納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的三種方法:
納米級Cu2O由于具有優良的催化性能而受到關注,下表為制取Cu2O的三種方法:| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法:2Cu+H2O $\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)炭粉在高溫條件下還原CuO易生成Cu;
(2)方法Ⅰ制備過程會產生有毒氣體為CO,生成1gCO,能量變化a kJ,則生成1molCO放出28a kJ的熱量,據此書寫熱化學方程式;
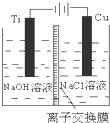
(3)在電解池的陽極發生失電子得還原反應;
(4)根據“液態肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2”來書寫化學方程式;
(5)在溶液中分離較大顆粒用過濾的方法;
(6)根據反應速率v=$\frac{△c}{△t}$來計算v(H2O),再據速率之比等于化學計量數之比求算v(O2);根據溫度對化學平衡移動的影響知識來回答;催化劑不會引起化學平衡狀態的改變,會使反應速率加快.
解答 解:(1)炭粉在高溫條件下還原CuO易生成Cu,反應不易控制,
故答案為:Cu;
(2)方法Ⅰ制備過程會產生有毒氣體為CO,生成1gCO,能量變化a kJ,則生成1molCO放出28a kJ的熱量,所以該反應的熱化學方程式為2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1 ,
故答案為:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1;
(3)在電解池中,當陽極是活潑電極時,該電機本身發生失電子得還原反應,在堿性環境下,金屬銅失去電子的電極反應為2Cu-2e-+2OH-=Cu2O+H2O,
故答案為:2Cu-2e-+2OH-=Cu2O+H2O;
(4)根據題目信息:液態肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2,得出化學方程式為:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案為:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(5)在溶液中,有較大的顆粒,用過濾法分離,
故答案為:過濾;
(6)實驗①前20min的平均反應速率 v(H2O)=$\frac{△c}{△t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7×10-5 mol•L-1 min-1,所以v(O2)=$\frac{1}{2}$×7×10-5 mol•L-1 min-1=3.5×10-5 mol•L-1 min-1;實驗溫度越高達到化學平衡時水蒸氣轉化率越大,②和③相比,③轉化率高所以T2>T1;催化劑不會引起化學平衡狀態的改變,會使反應速率加快,反應②比反應①達到平衡所用時間短,平衡狀態相同,反應速率快,所以①<②,
故答案為:3.5×10-5 mol•L-1 min-1;<;<.
點評 本題是一道有關熱化學、電化學以及化學反應速率和反應限度的綜合題,考查角度廣,難度大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑤⑥⑦②④③ | B. | ①⑤⑦⑥②④③ | C. | ①⑦⑤⑥②④③ | D. | A或B或C |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 開始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
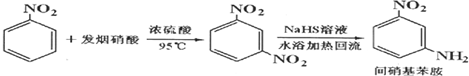
| 參考數據 | 組分 | 鄰硝基苯胺 | 間硝基苯胺 | 對硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸點/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶極矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 顏色 | 橙色 | 淡黃色 | 淡黃色 | 無色 | 無色 | 淡黃色 |

 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若反應開始時容器體積為2 L,則v(C)=0.4mol•L-1•min-1 | |
| B. | 若該反應在恒溫恒容下進行,放出熱量將增加 | |
| C. | 若2 min后,向容器中再投入等物質的量A、C,則B的轉化率不變 | |
| D. | 若在恒壓絕熱條件下反應,平衡后n(C)<1.6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
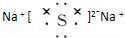 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com