
 錫有SnCl2、SnCl4兩種氯化物.SnCl4是無色液體,極易水解,熔點-36℃,沸點114℃,金屬錫的熔點為231℃.實驗室用熔融的金屬錫跟干燥的氯氣直接作用制取無水SnCl4(此反應過程放出大量的熱).實驗室制取無水SnCl4的裝置如圖所示.
錫有SnCl2、SnCl4兩種氯化物.SnCl4是無色液體,極易水解,熔點-36℃,沸點114℃,金屬錫的熔點為231℃.實驗室用熔融的金屬錫跟干燥的氯氣直接作用制取無水SnCl4(此反應過程放出大量的熱).實驗室制取無水SnCl4的裝置如圖所示.分析 (1)依據實驗室常見儀器回答;
(2)Sn在金屬活動性順序表中排在H的前面,較為活潑,據此解答即可;
(3)由信息可知SnCl4遇水水解,F中氫氧化鈉溶液中水蒸氣易揮發進入E中;
(4)依據題意:此反應過程放出大量的熱,故反應開始后,依靠反應放出的熱量即可使Sn熔化;產率=$\frac{實際產量}{理論產量}$×100%,據此解答即可;
(5)四氯化錫遇水強烈水解,生成SnO2、HCl,SnO2是固體顆粒,HCl結合空氣中的水蒸氣,出現白色煙霧;
(6)由于還原性Sn2+>I-,若產品中混有SnCl2,應能氧化碘離子生成碘單質,據此解答即可.
解答 解:(1)儀器A為蒸餾燒瓶,儀器B為冷凝管,又稱為冷凝器,故答案為:蒸餾燒瓶;冷凝管;
(2)Sn在金屬活動性順序表中排在H的前面,Sn可能與HCl反應生成SnCl2,故為了防止此反應的發生,需要除去氯氣中的HCl,由于SnCl4極易水解,故此需要干燥的氯氣,故答案為:Sn可能與HCl反應生成SnCl2;防止SnCl4水解;
(3)E收集產品,F中氫氧化鈉溶液中水蒸氣易揮發,進入E中,易使SnCl4水解.在E和F之間增加干燥裝置可以避免此種情況發生,故答案為:E、F之間連裝有堿石灰的干燥管;
(4)此反應過程放出大量的熱,故反應開始后,依靠反應放出的熱量即可使Sn熔化,11.9gSn粉的物質的量為:$\frac{11.9g}{119g/mol}$=0.1mol,故應生成SnCl4極的物質的量為0.1mol,即質量為:0.1mol×(119+4×35.5)g/mol=26.1g,產率=$\frac{23.8g}{26.1g}$×100%≈91.2%,故答案為:Sn和Cl2 反應放出大量的熱; 0.912;
(5)四氯化錫遇水強烈水解生成SnO2、HCl,SnO2是固體顆粒,HCl結合空氣中的水蒸氣,出現白色煙霧,故答案為:出現白色煙霧;
(6)依據所給信息:還原性Sn2+>I-,那么若產品中混有SnCl2,應能氧化碘離子生成碘單質,碘單質遇淀粉變藍,故實驗步驟為:取樣品少許,溶于稀鹽酸中,加2滴碘的淀粉溶液,振蕩,若紫色褪去,說明SnCl4混有少量的SnCl2,否則SnCl4純凈,
故答案為:取樣品少許,溶于稀鹽酸中,加2滴碘的淀粉溶液,振蕩,若紫色褪去,說明SnCl4混有少量的SnCl2,否則SnCl4純凈.
點評 本題主要考查的是制備實驗方案的設計,綜合性較強,難度較大,涉及知識點:實驗室常見儀器、鹽類水解原理、氧化還原反應原理等,充分利用所給信息是解決本題的關鍵.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案 各地期末復習特訓卷系列答案
各地期末復習特訓卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol溫度升高,平衡向逆方向移動,進一步消耗了氫氣而生成了CO,使CO轉化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol溫度升高,平衡向逆方向移動,進一步消耗了氫氣而生成了CO,使CO轉化率更低.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s時容器內c(Y)=0.76 mol/L | |
| B. | 830℃達平衡時,X的轉化率為80% | |
| C. | 反應達平衡后,升高溫度,平衡正向移動 | |
| D. | 1200℃時反應R(g)+Q(g)?X(g)+Y(g)的平衡常數K=0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
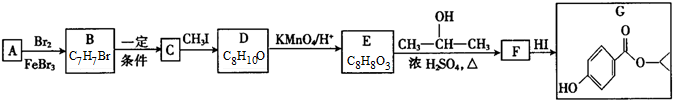
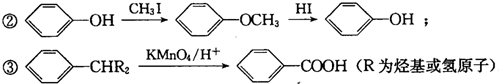
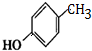 G的官能團名稱為羥基和酯基
G的官能團名稱為羥基和酯基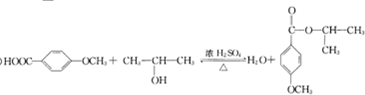
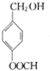
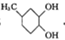

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 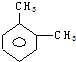 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 前者大 | B. | 后者大 | C. | 一樣大 | D. | 無法判斷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com