
| 溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s時容器內c(Y)=0.76 mol/L | |
| B. | 830℃達平衡時,X的轉化率為80% | |
| C. | 反應達平衡后,升高溫度,平衡正向移動 | |
| D. | 1200℃時反應R(g)+Q(g)?X(g)+Y(g)的平衡常數K=0.4 |
分析 A.反應初始4s內X的平均反應速率v(X)=0.005mol/(L•s),v(Y)=v(X)=0.005mol/(L•s),Y的起始濃度-△c(Y)=4s時c(Y);
B.設平衡時X的濃度變化量為x,利用三段式表示平衡時各組分的平衡濃度,代入平衡常數列方程計算x的值,再根據轉化率定義計算;
C.由表格可知,溫度升高,化學平衡常數減小,平衡逆向移動;
D.該反應X(g)+Y(g)?R(g)+Q(g)與R(g)+Q(g)?X(g)+Y(g)相反,則平衡常數互為倒數.
解答 解:A.反應初始4s內X的平均反應速率v(X)=0.005mol/(L•s),速率之比等于化學計量數之比,所以v(Y)=v(X)=0.005mol/(L•s),則4s內△c(Y)=0.005mol•L-1•s-1×4s=0.02mol/L,Y的起始濃度為$\frac{0.8mol}{2L}$=0.4mol/L,故4s時c(Y)=0.4mol/L-0.02mol/L=0.38mol/L,故A錯誤;
B.設平衡時A的濃度變化量為x,則:
X(g)+Y(g)?R(g)+Q(g)
開始(mol/L):0.1 0.4 0 0
變化(mol/L):x x x x
平衡(mol/L):0.1-x 0.4-x x x
故$\frac{{x}^{2}}{(0.1-x)(0.4-x)}$=1,解得x=0.08
所以平衡時X的轉化率為$\frac{0.08mol/L}{0.1mol/L}$×100%=80%,故B正確;
C.由表格可知,溫度升高,化學平衡常數減小,平衡逆向移動,不是正向移動,故C錯誤;
D.1200℃時反應X(g)+Y(g)?R(g)+Q(g)的平衡常數值為0.4,所以1200℃時反應R(g)+Q(g)?X(g)+Y(g)的平衡常數的值為$\frac{1}{0.4}$=2.5,故D錯誤.
故選B.
點評 本題考查化學反應速率、化學平衡常數的計算與運用等,為高考常見題型和高頻考點,側重于學生的分析、計算能力的考查,注意溫度不變時,平衡常數不變,化學方程式相反時,平衡常數互為倒數,難度中等.


科目:高中化學 來源: 題型:解答題
 某化學興趣小組為探究元索性質的遞變規律,設計了如下系列實驗.
某化學興趣小組為探究元索性質的遞變規律,設計了如下系列實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反應Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反應Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反應Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸的化學式 | CH3COOH | HCN | H2S |
| 電離常數 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物質的量濃度的各溶液pH關系為pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN與bmol/LNaOH溶液等體積混合,所得溶液中c(Na+)>c(CN-),則a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某濃度的NaCN溶液的pH=d,則其中由水電離出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
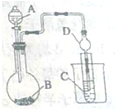
 錫有SnCl2、SnCl4兩種氯化物.SnCl4是無色液體,極易水解,熔點-36℃,沸點114℃,金屬錫的熔點為231℃.實驗室用熔融的金屬錫跟干燥的氯氣直接作用制取無水SnCl4(此反應過程放出大量的熱).實驗室制取無水SnCl4的裝置如圖所示.
錫有SnCl2、SnCl4兩種氯化物.SnCl4是無色液體,極易水解,熔點-36℃,沸點114℃,金屬錫的熔點為231℃.實驗室用熔融的金屬錫跟干燥的氯氣直接作用制取無水SnCl4(此反應過程放出大量的熱).實驗室制取無水SnCl4的裝置如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示甲、乙兩個裝置,所盛溶液體積和濃度均相同且足量,電極鋁和鎂都已除去表面氧化膜.當兩裝置電路中通過的電子都是1mol時,下列說法不正確的是( )
如圖所示甲、乙兩個裝置,所盛溶液體積和濃度均相同且足量,電極鋁和鎂都已除去表面氧化膜.當兩裝置電路中通過的電子都是1mol時,下列說法不正確的是( )| A. | 溶液的質量減小程度:乙<甲 | |
| B. | 溶液的導電能力變化:甲>乙 | |
| C. | 甲中陰極和乙中鎂電極上析出物質質量:甲=乙 | |
| D. | 電極反應式:甲中陽極:2Cl--2e→Cl2↑,乙中正極:Cu2++2e→Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硝酸工業發達 | B. | 雷雨天氣多 | C. | 機動車輛過多 | D. | 燃料以煤為主 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com