
| A. | 10 mL18.4mol•L-1濃硫酸與足量鋅反應,轉移電子數為0.184NA | |
| B. | 0.1 mol24Mg18O晶體中所含中子總數為2.0 NA | |
| C. | 在標準狀況下,2.8g N2和2.24L CO所含電子數均為1.4NA | |
| D. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的數目為NA |
分析 A.濃硫酸與足量鋅反應,開始生成二氧化硫氣體,濃硫酸變稀和鋅反應生成氫氣,結合氧化還原反應電子轉移計算分析;
B.質量數=質子數+中子數;
C.氮氣分子和一氧化碳分子是等電子體,且分子量相同,所以可以把混合物當作一種物質進行計算,根據氣體的物質的量和分子的構成計算電子數;
D.NaClO溶液中次氯酸根離子水解減小;
解答 解:A.濃硫酸與足量鋅反應,開始生成二氧化硫氣體,1mol硫酸被還原生成1mol二氧化硫,電子轉移2mol,濃硫酸變稀和鋅反應生成氫氣,稀硫酸反應1mol反應生成1mol氫氣單質轉移2mol,則10 mL18.4mol•L-1濃硫酸物質的量=0.010L×18.4mol•L-1=0.184mol,電子轉移0.184mol×2×NA=0.368NA,故A錯誤;
B.0.1 mol24Mg18O晶體中所含中子總數=0.1mol×(24-12+18-8)×NA=2.2NA,故B錯誤;
C.一個氮氣分子或一氧化碳分子中都含有14的電子,氮氣和一氧化碳的摩爾質量相等,所以可把兩種物質當成一種物質進行計算,2.8 g N2和2.8 g CO的物質的量都是0.1mol,含有的電子數都是1.4 NA,故C正確;
D.NaClO溶液中次氯酸根離子水解,1 L 1 mol•L-1的NaClO溶液中含有ClO-的數目小于NA,故D錯誤;
故選C.
點評 本題考查阿伏加德羅常數,題目難度不大,注意氧化還原反應電子轉移數的計算、鹽類水解、氣體摩爾體積計算條件等.


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
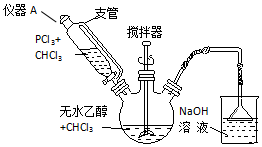
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
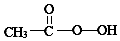 )常用作紡織品漂白劑.
)常用作紡織品漂白劑.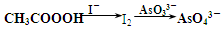
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體帶電荷,溶液不帶電荷 | |
| B. | 膠體區別于其它分散系的本質特征是分散質的直徑大小 | |
| C. | 將一柬光線通過膠體時可出現一條光亮的通路,通過溶液則沒有此現象 | |
| D. | 土壤膠粒的表面巨大且帶負電,能吸附NH${\;}_{4}^{+}$等營養離子,使土壤具有保肥能力 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應前后的氣體質量之比一定是1:3 | |
| B. | 兩種單質X、Y的摩爾質量之比是1:3 | |
| C. | 在生成物Z中,X的質量分數為50% | |
| D. | Z中X、Y兩元素的原子個數比為3:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50g | B. | 60mol/g | C. | 60g/mol | D. | 50g/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| B. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| C. | 與Al反應放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | 中性溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com