
| 實驗 編號 | HA物質的量 濃度(mol•L-1) | NaOH物質的量 濃度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
分析 (1)a中等體積等濃度混合,恰好生成正鹽,pH=9,則生成強堿弱酸鹽;
(2)若酸為強酸,等體積等濃度混合時pH=7;而HA為弱酸,等體積等濃度混合溶液的pH大于7,則為保證pH=7,應使酸濃度大于0.2mol/L;b中溶液pH=7,說明c(H+)=c(OH-),結合電荷守恒分析離子濃度關系;
(3)根據數據分析反應后的溶質為酸和等量的鹽,溶液顯酸性,說明酸的電離大于鹽的水解;
(4)根據溶液中的質子守恒分析.
解答 解:(1)根據a可知:等體積等濃度混合,恰好生成正鹽,溶液的pH=9,說明生成強堿弱酸鹽,所以HA為弱酸,
故答案為:HA是弱酸;
(2)若該酸為強酸,等體積等濃度混合時pH=7,而HA為弱酸,等體積等濃度混合溶液的pH大于7,則為保證pH=7,應使酸濃度應該大于0.2mol/L;
溶液的pH=7,溶液中c(H+)=c(OH-),由電荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)=c(Na+),
故答案為:大于;c(A-)=c(Na+);
(3)根據數據分析反應后的溶質為酸和等量的鹽,溶液顯酸性,說明HA的電離程度大于NaA的水解程度,則c(A-)>c(Na+),所以溶液中離子濃度關系為c(A-)>c(Na+)>c(H+)>c(OH-);
故答案為:大于;c(A-)>c(Na+)>c(H+)>c(OH-);
(4)實驗①中溶液中溶質為NaA,pH=9,則c(H+)=10-9mol/L,溶液中存在質子守恒:c(OH-)=c(H+)+c(HA),所以c(OH-)-c(HA)=c(H+)=10-9mol/L
;
故答案為:10-9.
點評 本題考查酸堿混合溶液的定性判斷及計算,把握鹽類水解、酸堿混合的物質的量關系及pH計算等為解答的關鍵,側重分析與計算能力的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 氫有三種同素異形體,分別是氕、氘、氚 | |
| B. | 氫有三種同位素,它們的相對原子質量分別是1、2、3 | |
| C. | 氫元素可形成三種互為通分異構體的物質:H2、D2、T2 | |
| D. | 氫元素的三種同位素原子可用一個原子結構示意圖表示 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
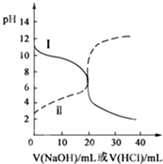 25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )
25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )| A. | 曲線Ⅰ:滴加溶液到10 mL時:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲線Ⅰ:滴加溶液到20 mL時:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲線Ⅱ:滴加溶液在10 mL~20 mL之間時:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲線Ⅱ:滴加溶液到10 mL時:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
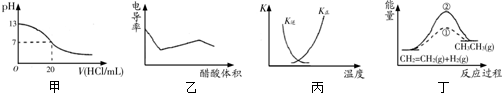
| A. | 甲表示25℃時用0.1 mol/L的鹽酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH隨加入鹽酸體積的變化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的電導率曲線 | |
| C. | 丙中曲線表示反應N2(g)+3H2(g)?2NH3(g)△H<0正、逆反應的平衡常數K隨溫度的變化 | |
| D. | 丁中①、②曲線分別表示反應CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化劑時,反應過程中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
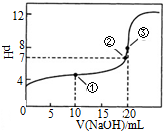 常溫下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲線如圖.下說法正確的是( )
常溫下,用0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液滴定曲線如圖.下說法正確的是( )| A. | 點①所示溶液中:c(CH3COOH)+c(CH3COO-)>2c(Na+) | |
| B. | 點③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 點③所示溶液中:c(CH3COO-)>c(Na+) | |
| D. | 滴定過程中可能出現:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知25℃時,0.10mol.L-1的CH3COOH的電離度為1.3%,pH=3.1.
已知25℃時,0.10mol.L-1的CH3COOH的電離度為1.3%,pH=3.1.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
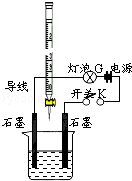 有酸溶液A,pH=a;堿溶液B,pH=b.為測定A、B混合后溶液導電性的變化以及探究A、B的相關性質,某同學設計了如圖所示的實驗裝置.常溫下,水的離子積Kw=1×10-14.
有酸溶液A,pH=a;堿溶液B,pH=b.為測定A、B混合后溶液導電性的變化以及探究A、B的相關性質,某同學設計了如圖所示的實驗裝置.常溫下,水的離子積Kw=1×10-14.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com