
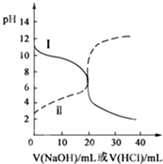
 25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )
25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )| A. | 曲線Ⅰ:滴加溶液到10 mL時:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲線Ⅰ:滴加溶液到20 mL時:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲線Ⅱ:滴加溶液在10 mL~20 mL之間時:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲線Ⅱ:滴加溶液到10 mL時:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 曲線I開始時pH>7,滴定過程中pH減小,是用鹽酸滴定氨水,曲線Ⅱ開始時pH<7,滴定過程中pH增大,是用氫氧化鈉滴定醋酸.
A.曲線Ⅰ是用鹽酸滴定氨水;
B.曲線I中滴加溶液到20mL時,得到NH4Cl溶液,溶液中銨根離子水解,溶液呈酸性;
C.曲線Ⅱ是用氫氧化鈉滴定醋酸;
D.曲線Ⅱ中滴加溶液到10mL時,得到等濃度的CH3COOH、CH3COONa混合溶液,結合微粒守恒、電荷守恒判斷.
解答 解:曲線I開始時pH>7,滴定過程中pH減小,是用鹽酸滴定氨水,曲線Ⅱ開始時pH<7,滴定過程中pH增大,是用氫氧化鈉滴定醋酸.
A.曲線Ⅰ是用鹽酸滴定氨水,故A錯誤;
B.曲線I中滴加溶液到20mL時,得到NH4Cl溶液,溶液中銨根離子水解,溶液呈酸性,則溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B錯誤;
C.曲線Ⅱ是用氫氧化鈉滴定醋酸,故C錯誤;
D.曲線Ⅱ中滴加溶液到10mL時,得到等濃度的CH3COOH、CH3COONa混合溶液,根據物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),根據電荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),聯立可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正確.
故選:D.
點評 本題考查中和滴定、離子濃度大小比較,關鍵是根據滴定曲線判斷相互滴定的物質,注意掌握溶液酸堿性與溶液pH的關系,能夠根據電荷守恒、物料守恒及鹽的水解判斷溶液中離子濃度大小.


科目:高中化學 來源: 題型:解答題
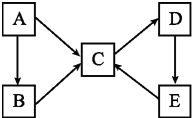 A、B、C、D、E五種物質(或離子)均含有同一種元素,它們之間有如圖所示的轉化關系:
A、B、C、D、E五種物質(或離子)均含有同一種元素,它們之間有如圖所示的轉化關系:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若a≤b,則混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,則[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1的鹽酸與0.1 mol•L-1的氨水混合,若溶液顯中性,則V(鹽酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸與等濃度等體積NaOH反應后的溶液中,CH3COOH和CH3COO-濃度關系為:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的鹽酸與pH=11的氨水混合,若溶液顯中性,則V(鹽酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等體積、等濃度的HCOONa和NaCN溶液中所含離子總數前者大于后者 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 用0.1032mol•L-1 HCl溶液滴定未知濃度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知濃度的NaOH溶液,| 滴定次數 | 待測溶液的體積(/mL) | 標準HCl溶液的體積 | |
| 滴定前讀數(/mL) | 滴定后讀數(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 己烷不能使Br2的四氯化碳溶液褪色而己烯能使其褪色 | |
| B. | 葡萄糖與新制的Cu(OH)2懸濁液共熱生成磚紅色而果糖不能 | |
| C. | 苯酚( )與溴的水溶液反應生成白色沉淀而甲苯不能 )與溴的水溶液反應生成白色沉淀而甲苯不能 | |
| D. | 乙烷與Cl2單質發生取代反應而乙烯與Cl2單質易發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗 編號 | HA物質的量 濃度(mol•L-1) | NaOH物質的量 濃度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
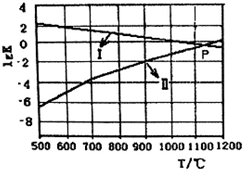 一種煤炭脫硫技術可以把硫元素以CaSO4的形成固定下來,可以減少SO2的排放,但產生的CO又會與CaSO4發生化學反應,從而降低脫硫效率.相關的熱化學方程式如下:
一種煤炭脫硫技術可以把硫元素以CaSO4的形成固定下來,可以減少SO2的排放,但產生的CO又會與CaSO4發生化學反應,從而降低脫硫效率.相關的熱化學方程式如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com