
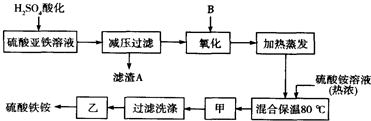
分析 原料中加入硫酸酸化,可生成硫酸鈣沉淀,減壓過濾后加入過氧化氫氧化可生成硫酸鐵,加入硫酸銨,在80℃下反應可生成硫酸鐵銨,經蒸發濃縮、冷卻結晶、過濾洗滌,最后經常溫晾曬可到純凈的硫酸鐵銨,結合對應物質的性質以及題目要求可解答該題.
(1)硫酸亞鐵中亞鐵離子水解,硫酸可以抑制水解,硫酸根離子可以將鈣離子沉淀;
(2)加入氧化劑可氧化亞鐵離子,但應避免引入新雜質;
(3)硫酸鐵銨經蒸發濃縮、冷卻結晶、過濾洗滌,最后經常溫晾曬可到純凈的硫酸鐵銨,但是溫度不能太高;
(4)根據酸性高錳酸鉀溶液氧化性很強,可以氧化二價鐵和雙氧水分析;
(5)檢驗NH4+的方法是加入強堿反應、加熱能夠產生使濕潤的紅色石蕊試液變藍的氣體,該氣體是氨氣,從而證明原溶液中一定含有NH4+;
(6)根據元素守恒結合發生的轉化來計算.
解答 解:原料中加入硫酸酸化,可生成硫酸鈣沉淀,減壓過濾后加入過氧化氫氧化可生成硫酸鐵,加入硫酸銨,在80℃下反應可生成硫酸鐵銨,經蒸發濃縮、冷卻結晶、過濾洗滌,最后經常溫晾曬可到純凈的硫酸鐵銨,
(1)加入硫酸,可增大溶液中SO42-濃度,將Ca2+轉化為沉淀,生成CaSO4,同時抑制Fe2+水解,
故答案為:增大溶液中SO42-濃度,將Ca2+轉化為沉淀或抑制Fe2+水解;CaSO4;
(2)為避免引入新雜質,應加入過氧化氫為氧化劑,還原產物是水,反應的離子方程式為H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案為:b;H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)在80℃下反應可生成硫酸鐵銨,經蒸發濃縮、冷卻結晶、過濾洗滌,最后經常溫晾曬可到純凈的硫酸鐵銨,溫度不能過高,防止分解,
故答案為:冷卻結晶;常溫晾曬;
(4)酸性高錳酸鉀溶液氧化性很強,可以氧化二價鐵和雙氧水,應加入鐵氰化鉀溶液,如生成藍色沉淀,可說明含有亞鐵離子,
故答案為:鐵氰化鉀溶液;不能;因為過氧化氫和二價鐵離子均能使酸性高錳酸鉀溶液褪色;
(5)檢驗NH4+的方法是加入強堿反應、加熱能夠產生使濕潤的紅色石蕊試液變藍的氣體,該氣體是氨氣,從而證明原溶液中一定含有NH4+,
故答案為:在試管中加入少量樣品和NaOH固體加熱,在試管口用濕潤的紅色石蕊試紙檢驗,看到試紙變成藍色;
(6)稱取14.00g樣品,將其溶于水配置成100mL溶液,分成兩等份,向其中一份中加入足量NaOH溶液,過濾洗滌得到2.14g沉淀,應為Fe(OH)3,
n(Fe(OH)3)=$\frac{2.14g}{107g/mol}$=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反應,則n(SO42-)=0.05mol,
所以14.00g樣品中含有Fe2(SO4)30.02mol,n(SO42-)為0.1mol,則(NH4)2SO4為0.1mol-0.02mol×3=0.04mol,
則m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化學式為Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案為:Fe2(SO4)3•2(NH4)2SO4•2H2O.
點評 本題考查考查物質的分離、提純制備,為高考常見題型,側重于學生的分析能力、實驗能力和計算能力的考查,注意根據物質的性質把握實驗原理和方法,難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 8種 | B. | 10種 | C. | 11種 | D. | 12種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大.其中基態A原子價電子排布式為nsnnpn+1;化合物B2E為離子化合物,E原子核外的M層中只有兩對成對電子;C元素是地殼中含量最高的金屬元素;D單質常用于制作太陽能電池和集成電路芯片;F原子最外層電子數與B的相同,其余各內層軌道均充滿電子.請根據以上信息,回答下列問題(答題時,A、B、C、D、E、F用所對應的元素符號表示):查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫有三種同素異形體,分別是氕、氘、氚 | |
| B. | 氫有三種同位素,它們的相對原子質量分別是1、2、3 | |
| C. | 氫元素可形成三種互為通分異構體的物質:H2、D2、T2 | |
| D. | 氫元素的三種同位素原子可用一個原子結構示意圖表示 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅作陽極,鐵制品作陰極,溶液中含有鋅離子 | |
| B. | 鋅作陰極,鐵制品作陽極,溶液中含有鋅離子 | |
| C. | 鋅作陽極,鐵制品作陰極,溶液中含有亞鐵離子 | |
| D. | 鋅作陰極,鐵制品作陽極,溶液中含有亞鐵離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
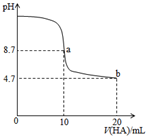 室溫下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的變化曲線如圖所示.下列說法正確的是( )
室溫下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的變化曲線如圖所示.下列說法正確的是( )| A. | a點所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b兩點所示溶液中水的電離程度相同 | |
| C. | b點所示溶液中c(A-)>c(HA) | |
| D. | 滴定過程中不可能出現c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
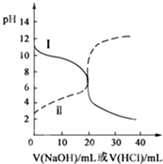 25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )
25℃時,取濃度均為0.1mol/L的醋酸溶液和氨水溶液各20mL,分別用0.1mol/LNaOH溶液、0.1mol/L鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如圖所示.下列說法正確的是( )| A. | 曲線Ⅰ:滴加溶液到10 mL時:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲線Ⅰ:滴加溶液到20 mL時:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲線Ⅱ:滴加溶液在10 mL~20 mL之間時:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲線Ⅱ:滴加溶液到10 mL時:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
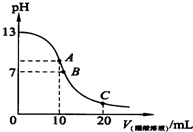 已知25℃時,0.10mol.L-1的CH3COOH的電離度為1.3%,pH=3.1.
已知25℃時,0.10mol.L-1的CH3COOH的電離度為1.3%,pH=3.1.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com