
 往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持續穩定地通入CO2氣體0.5mol.請以CO2的量為橫坐標,以溶液中離子的總量為橫坐標,畫出離子總量隨CO2加入量變化的折線圖.(不計弱電解質的電離和鹽的水解)
往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持續穩定地通入CO2氣體0.5mol.請以CO2的量為橫坐標,以溶液中離子的總量為橫坐標,畫出離子總量隨CO2加入量變化的折線圖.(不計弱電解質的電離和鹽的水解) 分析 n(CO2)=0.5mol,通入含有0.2mol氫氧化鈉和0.1mol氫氧化鈣的溶液中,通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相當于首先發生:Ca2++2OH-+CO2=CaCO3↓,然后發生2OH-+CO2=CO32-+H2O,再發生CO32-+CO2+H2O=2HCO3-、繼續通入反應CaCO3+CO2+H2O=Ca2++2HCO3-,再繼續通入二氧化碳溶液中離子物質的量不變,過程中發生的反應為:Ca2++2OH-+CO2=CaCO3↓,2OH-+CO2=CO32-+H2O,OH-+CO2+H2O=2HCO3-,CaCO3+CO2+H2O=Ca2++2HCO3-,以此解答該題.
解答 解:n(CO2)=0.5mol,
含有0.2mol氫氧化鈉和0.1mol氫氧化鈣的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol,
通入CO2,發生反應的離子方程式:Ca2++2OH-+CO2=CaCO3↓,2OH-+CO2=CO32-+H2O,OH-+CO2+H2O=2HCO3-,CaCO3+CO2+H2O=Ca2++2HCO3-,
通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相當于首先發生:Ca2++2OH-+CO2=CaCO3↓,該階段0.1molCa(OH)2完全反應消耗0.1molCO2,離子物質的量減少0.3mol,溶液中離子物質的量為0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molCaCO3;
然后發生2OH-+CO2=CO32-+H2O,0.2molOH-完全反應消耗0.1molCO2,該階段離子物質的量減少0.1mol,溶液中剩余離子物質的量為0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再發生CO32-+CO2+H2O=2HCO3-、消耗0.1molCO2,溶液中離子物質的量增大0.1mol,為0.2molHCO3-,0.2molNa+、共0.4mol離子,繼續通入反應CaCO3+CO2+H2O=Ca2++2HCO3-,消耗0.1molCO2,溶液中離子物質的量增大0.1moCa2+和0.2molHCO3-,溶液中離子為0.7mol,再繼續通入二氧化碳溶液中離子物質的量不變,
依據上述分析得到描點坐標為:(0,0.7)(0.1,0.4)(0.2,0.3)(0.3,0.4)(0.4,0.7)(0.5,0.7),描點畫出變化的曲線圖象為: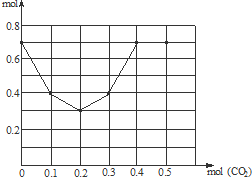
答:離子總量隨CO2加入量變化的折線圖為: .
.
點評 本題考查離子方程式的計算,題目難度中等,注意根據溶液中發生的反應結合各離子的物質的量計算分析,注意圖象中各階段離子的濃度變化.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 化學方程式 | 反應類型 |
| A | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | 化合反應 |
| B | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | 分解反應 |
| C | BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 | 復分解反應 |
| D | Fe3O4+4CO$\frac{\underline{\;高溫\;}}{\;}$3Fe+4CO2 | 置換反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:C>A | |
| B. | 離子半徑:D3+>B2- | |
| C. | 非金屬性:A>B | |
| D. | 最高價氧化物對應水化物的堿性:C<D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 只有難溶電解質才存在沉淀溶解平衡過程 | |
| B. | 沉淀溶解平衡過程是可逆的 | |
| C. | 在平衡狀態時v溶解=v結晶=0 | |
| D. | 達到沉淀溶解平衡的溶液一定是飽和溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加入適量的水 | B. | 適當升高溫度 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入等體積的濃度較大的鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
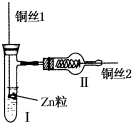 如圖為氫氣還原氧化銅的微型快速實驗裝置.實驗前先將銅絲1處理成下端彎曲的小圓環,并用鐵錘擊成帶小孔的小匙,將銅絲2一端彎曲成螺旋狀.試回答下列問題:
如圖為氫氣還原氧化銅的微型快速實驗裝置.實驗前先將銅絲1處理成下端彎曲的小圓環,并用鐵錘擊成帶小孔的小匙,將銅絲2一端彎曲成螺旋狀.試回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com